
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кількісні характеристики процесу дисоціації 2 страница
|
|
|
|
2K+ + 2HCO3– + 2Na+ + 2OH–  2K+ + CO32– + 2Na+ + CO32– + 2H2O
2K+ + CO32– + 2Na+ + CO32– + 2H2O
2HCO3– + 2OH–  2CO32– + 2H2O
2CO32– + 2H2O
HCO3– + OH–  CO32– + H2O
CO32– + H2O
Реакція є оборотною, але рівновага реакції зміщена у напрямку утворення води, тому що Н2О є більш слабким, тобто менш дисоційованим електролітом (К(H2O) = 1,8×10–16), ніж HCO3– (К(HCO3–) = 4,7×10–11).
в) Якщо до розчину, який містить осад аргентум хлориду білого кольору, додати розчин калій йодиду, то осад набуває жовтого кольору, який притаманний нерозчинному у воді аргентум йодиду AgІ. Це свідчить про перетворення аргентум хлориду на аргентум йодид за рівнянням:
AgCl↓ + КІ  AgІ↓ + КCl
AgІ↓ + КCl
Нерозчинні у воді сполуки AgCl та AgІ записуємо у вигляді молекул, а розчинні у воді середні солі КІ та КCl – у вигляді йонів:
AgCl + К + + І–  AgІ + К + + Cl–
AgІ + К + + Cl–
Виключаємо з обох частин рівняння йони К+ і одержуємо скорочене йонно-молекулярне рівняння реакції:
AgCl + І–  AgІ + Cl–
AgІ + Cl–
Оскільки осад стає жовтим, то можна зробити висновок, що рівновага зміщується у напрямку утворення AgІ. Це свідчить про те, що зв’язування йонів Ag+ у сполуку AgІ відбувається більш повною мірою, ніж у сполуку AgCl, тобто AgІ є менш розчинною сполукою, ніж AgCl.
г) Реакція взаємодії магній гідроксиду з розчином сульфатної кислоти відбувається за рівнянням:
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Нерозчинну у воді основу Mg(OH)2 та слабкий електроліт H2O слід записувати у вигляді молекул. Сульфатну кислоту та розчинну у воді середню сіль MgSO4 записуємо у вигляді йонів:
Mg(OH)2 + 2H+ + SO 42– = Mg2+ + SO 42– + 2H2O
Виключаючи йони SO42– з обох частин рівняння, записуємо скорочене йонно-молекулярне рівняння реакції:
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
Рівновага зміщується у напрямку утворення менш дисоційованої сполуки, якою є вода, і при додаванні достатньої кількості кислоти осад магній гідроксиду повністю розчиняється, тобто реакція стає необоротною.
Приклад 10. Розглянемо, чи відбувається взаємодія між речовинами, якщо не очікується утворення малодисоційованих сполук, наприклад, чи відбувається реакція взаємодії між натрій хлоридом та калій нітратом у розчині за рівнянням:
NaCl + KNO3 = NaNO3 + KCl
Всі ці середні солі добре розчиняються у воді і тому їх записують у вигляді йонів:
Na+ + Cl– + K+ + NO3– = Na+ + NO3– + K+ + Cl–
Оскільки йони змін не зазнають, то це означає що реакція не відбувається.
З розглянутих вище прикладів можна зробити такі висновки:
- Реакції відбуваються лише в тих випадках, якщо внаслідок їх перебігу утворюються малодисаційовані сполуки, тобто реакції відбуваються у напрямку утворення слабких електролітів, нерозчинних у воді або летких речовин.
- Реакція неможлива, якщо серед очікуваних продуктів реакції немає малодисоційованих сполук.
- Реакції є оборотними, якщо малодисоційовані сполуки є і серед вихідних речовин, і серед продуктів реакції.
- Рівновага оборотної реакції зміщується у напрямку більш повного зв’язування йонів у малодисоційовані сполуки, тобто у напрямку утворення більш слабкого електроліту, менш розчинної та більш леткої речовини.
- Реакція стає необоротною, якщо малодисоційована сполука є єдиною серед учасників реакції.
Гідроліз солей
Гідроліз солей – це взаємодія йонів солей з водою, що призводить до утворення малодисоційованих сполук, до яких належать слабкі електроліти, практично нерозчинні у воді та леткі речовини.
Будь-яку сіль можна уявити як продукт взаємодії основи і кислоти. В залежності від того, якими електролітами: сильними чи слабкими є ці кислота і основа – розрізняють такі випадки гідролізу солей.
І. Гідроліз солі, утвореної сильною основою і слабкою кислотою
Розглянемо гідроліз натрій ацетату NaCH3COO. Ця сіль є продуктом взаємодії сильної основи NaOH і слабкої кислоти CH3COOН. Натрій ацетат добре розчиняється у воді і повністю дисоціює на йони:
NaCH3COO = Na+ + СН3СОО–
В реакціях гідролізу беруть участь тільки ті йони солі, які здатні під час взаємодії з водою утворювати слабкі електроліти. Такими йонами у наведеному прикладі є ацетат-йони СН3СОО– (залишки слабкої кислоти), які відтягуюють від молекул води атоми гідрогену, зв’язучи їх в молекули слабкого електроліту – ацетатної кислоти СН3СООН і звільняючи при цьому йони ОН– :
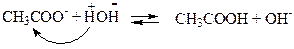
| (9.15) |
Йони Na+ не взаємодіють з водою, тому що не можуть зв’язати групи ОН води в молекули, оскільки NaOH – сильний електроліт і існує у розчині лише у вигляді йонів.
У розчині внаслідок гідролізу солі створюється надлишок йонів ОН– і розчин набуває лужної реакції ([OH–] > [H+], рН>7).
Для того, щоб написати рівняння (9.15) у молекулярному вигляді, потрібно об`єднати в молекули йони СН3СОО– та ОН– з йонами протилежного знаку, а саме з йонами Na+:
NaСН3СОО + Н2О  СН3СООН + NaОН
СН3СООН + NaОН
Сіль калій карбонат К2СО3 теж утворена сильною основою КОН та слабкою двохосновною кислотою Н2СО3, і у розчині існує у вигляді йонів: К2СО3 = 2К+ + СО32–
З водою взаємодіють лише йони, що є залишками слабкої кислоти, з якої утворена ця сіль, тобто йони СО32–. Оскільки йони СО32– є двозарядними, то ця взаємодія відбувається ступінчасто:
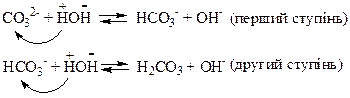
Йони СО32– при вза′ємодії з водою утворюють спочатку аніони кислої солі НСО3–, а вже за другим ступенем утворюються молекули карбонатної кислоти Н2СО3. Внаслідок цієї взаємодії розчин стає лужним (рН>7).
Гідроліз такої солі практично обмежується першим ступенем. Це пояснюється тим, що реакція відбувається переважно у напрямку утворення більш слабкого електроліту, яким є йони НСО3- (К(НСО3–) = =4,7×10–11), а не молекули Н2СО3 (К(Н2СО3) = 4,5×10–7): К(НСО3–) < К(Н2СО3).
Нижче наведені рівняння першого та другого ступенів гідролізу солі К2СО3 у молекулярному вигляді:
К2СО3 + Н2О  КНСО3 + КОН (перший ступінь)
КНСО3 + КОН (перший ступінь)
КНСО3 + Н2О  Н2СО3 + КОН (другий ступінь)
Н2СО3 + КОН (другий ступінь)
ІІ. Гідроліз солі, утвореної слабкою основою та сильною кислотою
Сіль амоній хлорид NH4Cl можна розглядати як сіль, що утворена слабкою основою NH4OH та сильною кислотою HCl.
Нижче наведений процес дисоціації солі на йони:
NH4Cl = NH4+ + Cl–
В реакції гідролізу беруть участь тільки йони NH4+, які є залишками слабкої основи, з якої утворена ця сіль. Йони NH4+ відтягують від води гідроксид-групи, звільняючи при цьому йони H+:
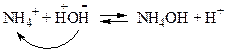
| (9.16) |
У розчині солі йони Н+ знаходяться у надлишку, тому розчин цієї солі набуває кислої реакції ([H+] > [OH–], рН<7).
Об`єднуючи йони NH4+ та H+ з йонами Cl– в молекули, дістанемо рівняння реакції (9.16) у молекулярному вигляді:
NH4Cl + H2O  NH4OH + HCl
NH4OH + HCl
Сіль купрум (ІІ) сульфат CuSO4, утворена теж сильною кислотою H2SO4 та малодисоційованою основою, якою є купрум (ІІ) гідроксид Cu(OH)2. Отже, у гідролізі солі беруть участь тільки йони Cu2+. Оскільки ці йони є двозарядними, тому гідроліз солі відбувається ступінчасто:

За першим ступенем йони Cu2+ при вза′ємодії з водою утворюють спочатку катіони основної солі CuOH+, а за другим ступенем – молекули Cu(OH)2. Розчин набуває кислої реакції (рН<7).
Внаслідок того, що йони CuOH+ є менш дисоційованим електролітом, ніж Cu(OH)2, гідроліз відбувається практично тільки за першим ступенем.
Нижче наведені рівняння першого та другого ступенів гідролізу солі CuSO4 в молекулярному вигляді:
2CuSO4 + 2H2O  (CuOH)2SO4 + H2SO4 (перший ступінь)
(CuOH)2SO4 + H2SO4 (перший ступінь)
(CuOH)2SO4 + 2H2O  2Сu(OH)2 + H2SO4 (другий ступінь)
2Сu(OH)2 + H2SO4 (другий ступінь)
ІІІ. Гідроліз солі, утвореної слабкою основою і слабкою кислотою
Прикладом такої солі може бути амоній ацетат NH4CH3COO, який є продуктом взаємодії слабкої основи NH4OH та слабкої кислоти CH3COOH і у розчині повністю дисоціює на йони:
NH4CH3COO = NH4+ + CH3COO–
Оскільки в реакціях гідролізу солей беруть участь йони, що є залишками слабких електролітів, з яких утворена сіль, то в даному випадку і йони NH4+, і йони СН3СОО- одночасно зв’язують відповідно гідроксид-групи та атоми гідрогену води в молекули NH4OH і СН3СООН:
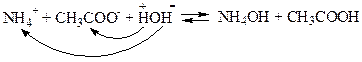
| (9.17) |
Реакція розчину залежить від співвідношення констант дисоціації утворених кислоти та основи. Оскільки константи дисоціації NH4OH і СН3СООН практично однакові (К=1,8×10–5), то основа NH4OH дисоціює з утворенням йонів ОН– (NH4OH  ОН– + NH4+) такою ж мірою, як і кислота СН3СООН – з утворенням йонів Н+ (CH3COOH
ОН– + NH4+) такою ж мірою, як і кислота СН3СООН – з утворенням йонів Н+ (CH3COOH  Н+ + CH3COO–). Отже, у розчині цієї солі концентрація йонів Н+ і ОН– однакова. Тому розчин є нейтральним ([OH–] = [H+], рН=7).
Н+ + CH3COO–). Отже, у розчині цієї солі концентрація йонів Н+ і ОН– однакова. Тому розчин є нейтральним ([OH–] = [H+], рН=7).
Сіль амоній карбонат (NH4)2CO3 теж утворена слабкою основою NH4OH та слабкою кислотою Н2СО3. Тому у гідролізі цієї солі теж беруть участь одночасно і йони NH4+, і йони СО32–:

| (9.18) |
Але константа дисоціації NH4OH (К(NH4OH)=1,8×10–5) більша за константу дисоціації йонів НСО3- (К(НСО3–) = 4,7×10–11), тобто NH4OH є менш слабким електролітом, ніж йони НСО3–. Отже, NH4OH дисоціює з утворенням йонів ОН– (NH4OH  ОН– + NH4+) більшою мірою, ніж йони НСО3– – з утворенням йонів Н+ (НСО3–
ОН– + NH4+) більшою мірою, ніж йони НСО3– – з утворенням йонів Н+ (НСО3–  Н+ + СО32–). Тому у розчині цієї солі переважають йони ОН- і розчин є лужним ([OH–] > [H+], рН>7).
Н+ + СО32–). Тому у розчині цієї солі переважають йони ОН- і розчин є лужним ([OH–] > [H+], рН>7).
Молекулярні рівняння реакцій (9.17) та (9.18) мають такий вигляд:
NH4CH3COO + H2O  NH4OH + CH3COOH
NH4OH + CH3COOH
(NH4)2CO3 + H2O  NH4OH + NH4HCO3
NH4OH + NH4HCO3
Гідроліз розглянутих вище солей є процесом оборотним. Пряма реакція відбувається у напрямку утворення слабких електролітів, якими є або основа, або кислота, або і основа, і кислота, а зворотна – у напрямку утворення теж слабкого електроліту – води. У рівняннях цих реакцій записують знак оборотності.
Якщо продукти гідролізу виходять зі сфери реакції, тобто, якщо утворюються нерозчинні або леткі речовини, то гідроліз таких солей – процес необоротний.
Прикладом такого випадку є гідроліз алюміній сульфіду:
Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S
В рівняннях необоротного процесу записують знак рівності.
IV. Солі, утворені сильною основою і сильною кислотою, гідролізу не піддаються, оскільки йони таких солей не здатні утворювати з водою слабкі електроліти.
Тому рівновага дисоціації води на йони Н2О  Н+ + ОН– не порушується і концентрація йонів Н+ і ОН– у розчині цих солей залишається такою ж самою, як і в чистій воді. Розчини таких солей, як NaClO4, KCl, KNO3, Na2SO4, CaCl2, Ba(NO3)2 тощо, є нейтральними (рН»7).
Н+ + ОН– не порушується і концентрація йонів Н+ і ОН– у розчині цих солей залишається такою ж самою, як і в чистій воді. Розчини таких солей, як NaClO4, KCl, KNO3, Na2SO4, CaCl2, Ba(NO3)2 тощо, є нейтральними (рН»7).
Висновки:
Для складання рівнянь гідролізу солей потрібно:
1) написати процес дисоціації солі на йони;
2) вказати, якою основою та якою кислотою утворена сіль;
3) визначити, до яких електролітів: сильних чи слабких – належать ці основа та кислота;
4) скласти йонно-молекулярне рівняння реакції взаємодії з водою тільки тих йонів солі, що є залишками слабких (малодисоційованих) електролітів, з яких утворена ця сіль;
5) якщо ці йони є багатозарядними, то гідроліз солі відбувається ступінчасто, і тому рівняння гідролізу складають окремо для кожного ступеня;
6) вказати реакцію розчину солі (рН);
6) скласти молекулярне рівняння гідролізу солі.
Кількісні характеристики процесу гідролізу солей
Кількісно гідроліз солі оцінюють за ступенем гідролізу і константою гідролізу.
Ступінь гідролізу солі b показує, яка частка розчиненої солі піддається гідролізу:
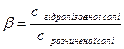 (9.19)
(9.19)
Ступінь гідролізу солей у більшості незначний, тому що один з учасників реакції гідролізу – вода є найбільш слабким електролітом і рівновага реакції значною мірою зміщена у напрямку вихідних речовин.
Нижче наведені рівняння реакцій гідролізу таких солей:
а) калій ціаніду KCN, утвореного сильною основою КОН і слабкою кислотою НСN;
б) амоній нітрату NH4NO3, утвореного слабкою основою NH4OH і сильною кислотою НNO3:
а) СN– + H2O  HCN + OH–, (9.20)
HCN + OH–, (9.20)
б) NH4+ + H2O  NH4OH + H+ (9.21)
NH4OH + H+ (9.21)
Як випливає з цих рівнянь, концентрація йонів ОН- (9.20) та йонів Н+ (9.21), які знаходяться у розчинах солей в надлишку, дорівнює концентрації гідролізованої солі.
Тому ступінь гідролізу солей дорівнює:
а)  (9.22)
(9.22)
б)  (9.23)
(9.23)
Ступінь гідролізу солі залежить від температури та концентрації солі у розчині.
Гідроліз солі можна розглядати як процес, обернений реакції нейтралізації, тобто реакції взаємодії кислоти з основою. Оскільки реакція нейтралізації є екзотермічною, то гідроліз солі – ендотермічна реакція. За принципом Ле Шательє підвищення температури зміщує рівновагу у напрямку ендотермічної реакції, якою є гідроліз солі. Тому за нагрівання розчину солі ступінь її гідролізу збільшується.
За розбавляння розчину зменшується концентрація солі у розчині і збільшується кількість молекул води, що припадають на один йон солі. За принципом Ле Шательє рівновага реакції зміщується у напрямку зменшення кількості води, тобто у напрямку перебігу реакції гідролізу солі. Тому за розбавляння розчину солі ступінь її гідролізу збільшується.
Отже, і нагрівання, і розбавляння розчинів сприяють перебігу реакції гідролізу солей. Тому для послаблення гідролізу солей, тобто для зменшення ступеня їх гідролізу, потрібно зберігати розчини з високою концентрацією солі та за низьких температур.
Крім того, зміщенню рівноваги процесів (9.20) та (9.21) у зворотному напрямку сприяє збільшення концентрації йонів ОН– в реакції (9.20), тобто додавання розчину лугу до розчину солі KCN, а в реакції (9.21) – збільшення концентрації йонів Н+, тобто додавання розчину кислоти до розчину солі NH4NO3. Таким чином, до зменшення ступеня гідролізу солі призводить додавання до розчину солі одного з продуктів гідролізу – кислоти або лугу.
Оскільки гідроліз солі є оборотним процесом, то його можна охарактеризувати константою рівноваги, яка називається у цьому випадку константою гідролізу солі Кг.
В розбавлених розчинах концентрація води є практично сталою величиною, тому вираз константи гідролізу солей (9.20) та (9.21) має такий вигляд:
а) 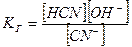 , (9.24)
, (9.24)
б) 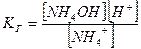 (9.25)
(9.25)
Помноживши чисельник і знаменник виразу (9.24) на концентрацію йонів Н+, а виразу (9.25) на концентрацію йонів ОН–, отримаємо:
а) 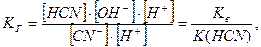 (9.26)
(9.26)
б) 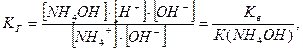 (9.27)
(9.27)
де [H+]×[ОН–] – це йонний добуток води Кв,
а  - константа дисоціації слабкої кислоти К(HCN),
- константа дисоціації слабкої кислоти К(HCN),
 - константа дисоціації слабкої основи К(NH4OH).
- константа дисоціації слабкої основи К(NH4OH).
За аналогією можна показати, що константа гідролізу солі, утвореної слабкою основою і слабкою кислотою, дорівнює:
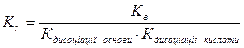 (9.28)
(9.28)
Ступінь гідролізу та константа гідролізу солей зв’язані між собою виразом, який має вигляд, подібний виразу (9.5):
 (9.29)
(9.29)
Якщо b<<1, то вираз (9.29) спрощується:
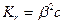 (9.30)
(9.30)
З виразів (9.26), (9.27) і (9.28) можна зробити висновок, що, чим менша константа дисоціації слабких електролітів, утворених внаслідок гідролізу солей, тобто, чим слабкішими є ці електроліти, тим більшою є константа гідролізу солі, а згідно з виразом (9.30) – більшим є і ступінь гідролізу солі, тобто повніше гідролізуватиме сіль.
Приклад 11. Константа гідролізу натрієвої солі слабкої одноосновної кислоти НА дорівнює 2,5×10-8. Розрахуйте:
а) ступінь гідролізу солі у розчині з концентрацією солі с(NaA) = 0,004 моль/л;
б) рОН та рН розчину солі;
в) константу дисоціації кислоти НА.
Розв'язання.
Оскільки сіль утворена сильною основою NaОН та слабкою кислотою НА, у гідролізі солі беруть участь тільки йони А– (NaА =Na+ + А–):
А– + Н2О  НА + ОН– (9.31)
НА + ОН– (9.31)
а) Знаходимо ступінь гідролізу солі за виразом (9.30):
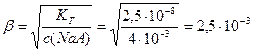
б) За виразом (9.22) розрахуємо концентрацію йонів ОН–, які утворюються у розчині внаслідок гідролізу солі за рівнянням (9.31):
[OH–] = b с(NaA) = 2,5×10–3 × 4×10–3 моль/л = 10–5 моль/л.
Згідно з виразами (9.11) та (9.12):
pOH = –lg[OH–] = –lg10–5 = 5,
pH = 14 – pOH = 9
в) Обчислимо константу дисоціації кислоти НА (9.26):
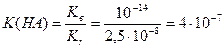
Приклад 12. Розрахуйте а) константу гідролізу солі, утвореної слабкою основою ХОН та нітратною кислотою; б) ступінь її гідролізу у розчині з концентрацією солі с(ХNO3)=0,5 моль/л; в) рН розчину солі. Константа дисоціації основи ХОН дорівнює: К(ХОН)=5×10-7.
Розв'язання.
Оскільки нітратна кислота HNO3 є сильним електролітом, у гідролізі солі беруть участь тільки йони слабкої основи Х+ (ХNO3 =Х+ + NO3–):
Х+ + Н2О  ХОН + Н+ (9.32)
ХОН + Н+ (9.32)
а) Розрахуємо константу гідролізу солі (9.27):

б) Обчислимо ступінь гідролізу солі (9.30):

в) За виразом (9.23) розрахуємо концентрацію йонів Н+, які утворюються за рівнянням (9.32), та рН розчину (9.10):
[H+] = b c(XNO3) = 2×10–4 × 0,5 моль/л = 10–4 моль/л
рН = –lg[H+] = –lg10–4 = 4
РОЗДІЛ ІV. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Окисно-відновні реакції – це реакції, які супроводжуються зміною ступенів окиснення атомів елементів, що входять до складу реагуючих речовин.
Ступінь окиснення – це умовний заряд атома у сполуці, який виник би у разі повного зміщення спільних електронних пар до атомів більш електронегативних елементів.
Правила визначення ступенів окиснення атомів:
1. В простих речовинах ступінь окиснення атомів дорівнює “0”:

2. В сполуках ступінь окиснення атомів більш електронегативних елементів позначають знаком “–“, а менш електронегативних елементів – знаком “+”.
3. Найвищий ступінь окиснення атомів більшості неметалів і металів у сполуках є позитивним і чисельно дорівнює номеру групи періодичної системи, в якій розташований елемент.
4. Найнижчий ступінь окиснення атомів неметалів в сполуках є негативним і дорівнює “8 – номер групи періодичної системи”.
Ступінь окиснення атомів металів в сполуках завжди позитивний. Отже, їх найнижчий ступінь окиснення дорівнює “0”.
5. Ступінь окиснення атомів оксигену дорівнює:
– у більшості сполук, а саме, в оксидах, кислотах, основах та солях – “-2”:
 ;
;
– в пероксидах – “-1”:
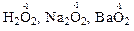 ;
;
–  в сполуці з флуором – “+2”, оскільки флуор є найбільш електронегативним елементом:
в сполуці з флуором – “+2”, оскільки флуор є найбільш електронегативним елементом:
6. Ступінь окиснення атомів гідрогену дорівнює:
– в сполуках з неметалами – “+1”, тому що гідроген є менш електронегативним елементом, ніж більшість неметалів:
 ;
;
– в сполуках з металами (гідридах) – “-1”, оскільки гідроген є більш електронегативним елементом, ніж метали:
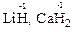
7. Алгебраїчна сума ступенів окиснення всіх атомів в молекулі дорівнює нулю.
Приклад 1. Розрахуйте ступінь окиснення атомів підкреслених елементів в сполуках: K2 Cr 2O7, H N O3, Al 2O3.
Розв’язання.
Поставимо над символами елементів ступінь окиснення їх атомів, користуючись наведеними вище правилами.
Ступінь окиснення атомів гідрогену та оксигену в цих сполуках дорівнює відповідно “+1” та “-2”. Елемент калій знаходиться в групі І періодичної системи і виявляє металічні властивості. Тому ступінь окиснення його атомів в сполуках становить “+1”.
Враховуючи, що алгебраїчна сума ступенів окиснення всіх атомів в молекулі дорівнює нулю, обчислимо ступінь окиснення атомів підкреслених елементів:

2·(+1)+2·х+7·(-2)=0 +1+х+3·(-2)=0 2·х+3·(-2)=0
х=+6 х=+5 х=+3
–– –– –– –– –– ––
Розглянемо реакцію взаємодії алюмінію з киснем, яка відбувається за рівнянням:
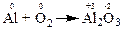
Реакція належить до окисно-відновних, тому що супроводжується зміною ступенів окиснення атомів алюмінію та оксигену: в простих речовинах їх ступінь окиснення дорівнює “0”, а в оксиді – відповідно “+3” та “-2”.
Отже, атом алюмінію віддає три електрони, набуваючи в оксиді ступеня окиснення “+3”:
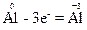
Віддавання атомом електронів називається окисненням, а сам атом та речовина, яка містить такий атом, – відновником.
В цій реакції відновником є проста речовина алюміній. Атоми- відновники, тобто атоми алюмінію, окиснюються і їх ступінь окиснення підвищується від 0 до “+3”.
Відновник є одночасно і відновленою формою (Red) речовини, яка під час перебігу реакції перетворюється у її окиснену форму (Ох).
В реакції, що розглядається, відновленою формою алюмінію є проста речовина алюміній, що перетворюється у його окиснену форму (Ох) – алюміній оксид, в якій атоми алюмінію набувають ступеня окиснення “+3”.
Кожний атом оксигену в молекулі кисню приєднує два електрони, а два атоми приєднують чотири електрони:
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1096; Нарушение авторских прав?; Мы поможем в написании вашей работы!