
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація окисно-відновних реакцій
|
|
|
|
Реакції міжмолекулярного окиснення-відновлення – це реакції, в яких окисником та відновником є атоми елементів, що знаходяться у складі різних речовин.
У наведеному нижче, як приклад, рівнянні реакції розставляємо ступені окиснення всіх атомів і підкреслимо атоми тих елементів, які під час перебігу реакції змінили свій ступінь окиснення:

Отже, змінюється ступінь окиснення атомів брому та хлору.
Складаємо електронні схеми процесів окиснення та відновлення:
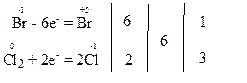
За правилом електронного балансу перед молекулою Cl2 ставимо коефіцієнт 3, а потім розставляємо коефіцієнти перед іншими речовинами так, щоб число атомів калію, хлору, гідрогену та оксигену було однаковим і в лівій, і в правій частинах рівняння:
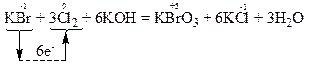
Атом-відновник, тобто атом брому зі ступенем окиснення “-1”, віддає електрони, тобто окиснюється і продуктом його окиснення є атом брому зі ступенем окиснення “+5” в молекулі KBrO3. Речовина KBr, у складі якої міститься атом Br-1, є відновником.
Атоми-окисники, тобто атоми хлору зі ступенем окиснення “0”, приєднують електрони і відновлюються з утворенням продуктів відновлення, якими є атоми хлору зі ступенем окиснення “-1” в молекулах KCl. Проста речовина хлор, у складі якої містяться атоми Cl0 є окисником.
Отже, в цьому прикладі атом-відновник і атоми-окисники знаходяться у складі молекул різних речовин.
Перехід електронів від атома-відновника до атомів-окисників позначений стрілкою.
Реакції внутрішньомолекулярного окиснення-відновлення – це реакції, в яких окисником та відновником є атоми різних елементів або атоми одного і того ж елемента, але з різним ступенем окиснення, які знаходяться в молекулах однієї і тієї ж речовини.
Прикладом є реакція термічного розкладу калій хлорату за рівнянням:
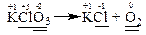
В цій реакції змінюють свій ступінь окиснення атоми хлору та оксигену, які містяться в молекулі KClO3.
Запишемо електронні схеми процесів окиснення та відновлення:
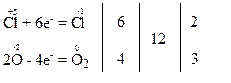
За правилом електронного балансу розставляємо коефіцієнти: перед молекулами KCl та O2 – відповідно 2 та 3, і коефіцієнт 2 перед молекулою KClO3 для того, щоб число атомів калію, хлору та оксигену було однаковим в обох частинах рівняння:
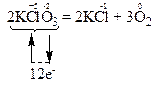
Окисниками є атоми хлору зі ступенем окиснення “+5” в молекулах KClO3. Вони приєднують електрони, тобто відновлюються. Продуктами їх відновлення є атоми хлору зі ступенем окиснення “-1” в молекулах KCl.
Відновниками є атоми оксигену зі ступенем окиснення “-2” в молекулах KClO3. Вони віддають електрони, тобто окиснюються. Продуктами їх окиснення є атоми оксигену зі ступенем окиснення “0” в молекулах кисню.
Отже, окисники (атоми Cl+5) та відновники (атоми О–2) знаходяться у складі молекул однієї і тієї ж речовини KClO3.
Перехід електронів від атомів-відновників до атомів-окисників позначений у рівнянні реакції стрілкою.
В реакції за рівнянням:
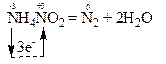
відбувається перехід електронів від одного атома нітрогену зі ступенем окиснення “-3” до іншого атома нітрогену зі ступенем окиснення “+3”, які знаходяться в молекулі NH4NO2:
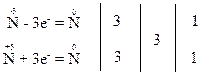
Відновником є атом нітрогену зі ступенем окиснення “-3”, він віддає електрони і продуктом його окиснення є атом нітрогену зі ступенем окиснення “0”. Окисником є атом нітрогену зі ступенем окиснення “+3”, він приєднує електрони і продуктом його відновлення є також атом нітрогену зі ступенем окиснення “0”.
Оскільки окисником (атом N+3) та відновником (атом N-3) є атоми одного і того ж елемента, але з різним ступенем окиснення, що знаходяться в молекулі однієї і тієї ж речовини NH4NO2, то ця реакція належить до реакцій внутрішньомолекулярного окиснення-відновлення.
Реакції самоокиснення-самовідновлення – це реакції, в яких окисником та відновником є атоми одного і того ж елемента з однаковим проміжним ступенем окиснення, які знаходяться у складі молекул однієї і тієї ж речовини.
Прикладом є реакція, яка відбувається за таким рівнянням:
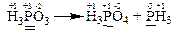
В цій реакції змінюють свій ступінь окиснення тільки атоми фосфору, що містяться в молекулах H3PO3.
Запишемо електронні схеми процесів окиснення та відновлення:
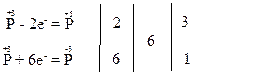
За правилом електронного балансу перед молекулою H3PO4 ставимо коефіцієнт 3. Для того, щоб число атомів фосфору, гідрогену та оксигену було однаковим і в лівій, і в правій частинах рівняння, перед молекулою H3PO3 ставимо коефіцієнт 4:
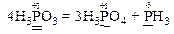
В цій реакції і окисником, і відновником є атоми одного і того ж елемента з однаковим проміжним ступенем окиснення (атоми Р+3), що знаходяться в молекулах однієї і тієї ж речовини H3PO3. Отже, речовина H3PO3 виявляє властивості як окисника, так і відновника.
Перехід електронів від атомів-відновників до атома-окисника позначений стрілкою:
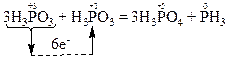
Продуктом окиснення відновників (атомів Р+3) є атоми фосфору зі ступенем окиснення “+5” в молекулах H3PO4, а продуктом відновлення окисника (атома Р+3) є атом фосфору зі ступенем окиснення “-3” в молекулі PH3.
Приклад 4. Розставте ступені окиснення елементів в наведених рівняннях окисно-відновних реакцій. Вкажіть тип окисно-відновних реакцій. За правилом електронного балансу доберіть коефіцієнти в рівняннях реакцій:
а) KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O
б) Pb(NO3)2 → PbO + NO2 + O2
в) H2O2 → H2O + O2
Розв’язання.
Розставляємо ступені окиснення атомів елементів в рівняннях реакцій і підкреслимо атоми, ступені окиснення яких змінились внаслідок перебігу реакцій.
а) В цій реакції змінюють свій ступінь окиснення атом мангану в молекулі KMnO4 та атом сульфуру в молекулі H2S.
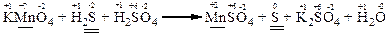
Електронні схеми процесів окиснення та відновлення:

Користуючись правилом електронного балансу, ставимо перед молекулою KMnO4 коефіцієнт 2, а перед молекулою H2S – коефіцієнт 5, і переносимо ці коефіцієнти у праву частину рівняння, тобто ставимо перед речовинами MnSO4 та S відповідно 2 та 5. Перед іншими речовинами ставимо такі коефіцієнти, щоб число кислотних залишків SO42– та атомів гідрогену було однаковим в обох частинах рівняння: перед молекулою Н2SO4 ставимо коефіцієнт 3, а перед молекулою Н2О – 8.
Остаточне рівняння реакції має такий вигляд:
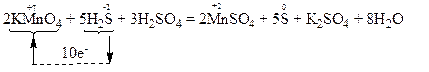
Атом-відновник, тобто атом сульфуру зі ступенем окиснення “-2” окиснюється, підвищуючи свій ступінь окиснення. Отже, речовина H2S є відновником. Продуктом окиснення відновника є проста речовина сірка, в якій ступінь окиснення атомів сульфуру дорівнює “0”.
Атом-окисник, тобто атом мангану зі ступенем окиснення “+7” відновлюється, понижуючи свій ступінь окиснення. Отже, речовина KMnO4 є окисником. Продуктом відновлення окисника є сіль MnSO4, в якій міститься атом мангану зі ступенем окиснення “+2”.
Перехід електронів від атомів-відновників до атомів-окисників в рівнянні реакції позначений стрілкою.
Оскільки атоми-окисники та атоми-відновники знаходяться у складі молекул різних речовин, то ця реакція належить до реакцій міжмолекулярного окиснення-відновлення.
б) В цій реакції змінюють свій ступінь окиснення атоми нітрогену та оксигену, які знаходяться в молекулі Pb(NО3)2.
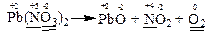
Електронні схеми процесів окиснення та відновлення:
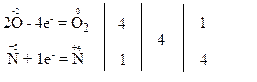
За правилом електронного балансу ставимо перед молекулою NO2 коефіцієнт 4. Для того, щоб число одних і тих же атомів було однаковим і в лівій, і правій частинах рівняння, поставимо коефіцієнт 2 перед молекулою Pb(NО3)2.
Остаточне рівняння реакції:
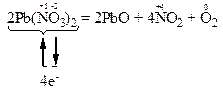
Відновниками є тільки два атоми оксигену зі ступенем окиснення “-2” з 12 атомів, що містяться в двох молекулах Pb(NО3)2, а окисниками – атоми нітрогену зі ступенем окиснення “+5”, що знаходяться також в молекулах Pb(NО3)2. Отже, окисниками та відновниками є атоми різних елементів, що містяться в молекулах однієї і тієї ж речовини. Тому ця реакція належить до реакцій внутрішньомолекулярного окиснення-відновлення.
Продуктами окиснення відновників (атомів О–2) є атоми оксигену зі ступенем окиснення “0” в молекулі O2, а продуктами відновлення окисників (атомів N+5) є атоми нітрогену зі ступенем окиснення “+4” в молекулах NО2.
Перехід електронів від атомів-відновників до атомів-окисників позначений стрілкою.
в) В цій реакції змінюють свій ступінь окиснення тільки атоми оксигену, що входять до складу молекули Н2О2.
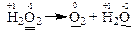
Запишемо електронні схеми процесів окиснення та відновлення:
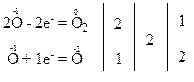
За правилом електронного балансу ставимо перед молекулою Н2О коефіцієнт 2. Для того, щоб число атомів оксигену та гідрогену було одноковим в обох частинах рівняння, поставимо перед молекулою Н2О2 коефіцієнт 2.
Остаточне рівняння реакції має такий вигляд:
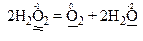
В цій реакції атоми одного і того ж елемента з проміжним ступенем окиснення (атоми О–1), що знаходяться в молекулах однієї і тієї ж речовини Н2О2, і віддають, і приєднують електрони, тобто виявляють властивості і відновників, і окисників. Отже, речовина Н2О2 є і відновником, і окисником. Тому ця реакція належить до реакцій самоокиснення-самовідновлення. Перехід електронів від атомів-відновників до атомів-окисників позначений стрілкою:
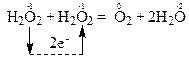
Продуктами окиснення атомів-відновників (О-1) є атоми оксигену зі ступенем окиснення “0” в молекулі кисню. А продуктами відновлення атомів-окисників (О-1) є атоми оксигену зі ступенем окиснення “-2” в молекулах води.
РОЗДІЛ V. ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
10. ГальванічНІ елементи
Електрохімія вивчає взаємні перетворення хімічної та електричної енергії. Відповідно до визначення електрохімічні процеси поділяють на дві основні групи: 1) процеси перетворення хімічної енергії на електричну (процеси у гальванічних елементах), 2) процеси перетворення електричної енергії на хімічну (електроліз).
В електрохімії використовують поняття “електрод”. Електрод – це електронний провідник, що знаходиться в контакті з йонним провідником, тобто з розчином або розплавом електроліту.
Розглянемо у якості електрода металічну пластину, занурену у водний розчин солі цього металу. Кристалічна решітка металу складається з атомів та катіонів металу, між якими вільно рухаються валентні електрони. У розчині солі катіони металу оточені полярними молекулами води, тобто перебувають у вигляді гідратів.
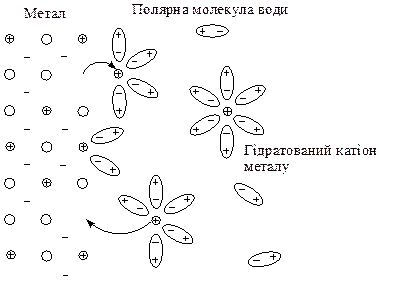
В залежності від хімічної природи металів на поверхні металу можливі такі процеси:
В першому випадку, як наприклад, на поверхні пластини цинку, зануреної у розчин солі ZnSO4, катіони металу, що розташовані у вузлах кристалічної решітки, під дією полярних молекул води здатні переходити з поверхні металу у розчин, залишаючи на поверхні електрони, заряд яких не компенсується катіонами металу. Поверхня металу набуває негативного заряду, а біля поверхні у розчині внаслідок електростатичного притягання зосереджуються катіони металу.
У другому випадку, як, наприклад, на поверхні мідної пластини, зануреної у розчин солі CuSO4, катіони металу, що знаходяться у розчині, під дією притягання електронів на поверхні металу здатні, залишаючи свою гідратну оболонку, переходити у склад кристалічної решітки. В цьому випадку поверхня металу набуває позитивного заряду, а біля поверхні у розчині зосереджуються аніони кислотного залишку: у розглянутому прикладі – це йони SO42-.
По мірі зростання заряду поверхні металу та збільшення концентрації йонів протилежного знаку у розчині біля поверхні, стає можливим перехід катіонів металу у зворотному напрямку: в першому випадку – з розчину до металу, а в другому – з металу у розчин. З часом швидкість переходу катіонів металу в обох напрямках стає однаковою, тобто встановлюється рівновага.
Але в першу мить контакту електрода з електролітом перехід катіонів металу відбувається переважно в одному напрямку. Це призводить до утворення подвійного електричного шару: один шар – це поверхня металу, а інший – шар йонів біля поверхні. Між цими двома шарами, тобто між поверхнею електрода та електролітом, виникає різниця потенціалів, яка називається електродним потенціалом і позначається “φ”.
Подвійний електричний шар на межі поділу:
| а) цинковий електрод – розчин солі ZnSO4; | б) мідний електрод – розчин солі CuSO4. |
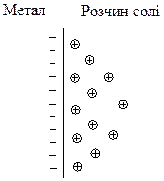
| 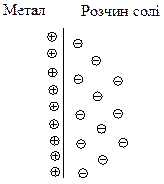
|
Гальванічний елемент (ГЕ) – це пристрій, в якому енергія хімічної реакції, а саме, окисно-відновної реакції, перетворюється безпосередньо на електричну енергію.
Отже, гальванічний елемент – це хімічне джерело електроенергії.
Гальванічний елемент складається з двох електродів, занурених у розчини певних електролітів і з’єднаних між собою металічним провідником (зовнішнє коло), а розчини електролітів розділяються пористою перегородкою (внутрішнє коло).
Умовне позначення складу гальванічного елемента має назву “ схема ГЕ ”:
(Анод) електрод | електроліт || електроліт | електрод (Катод)
“–” I I II II “+”
В схемі ГЕ одна вертикальна риса – це межа поділу між електродом та електролітом, а дві вертикальні риси – межа поділу між електролітами.
Внаслідок різної величини електродних потенціалів на одному з електродів відбувається окиснення (віддавання електронів певною речовиною). Цей електрод називається анодом, а окиснення на його поверхні – анодним процесом. Електрони по металічному провіднику, який з’єднує електроди, рухаються від анода до іншого електрода, на поверхні якого відбувається відновлення (приєднання електронів певними частинками електроліту). Цей електрод називається катодом, а відновлення на його поверхні – катодним процесом.
Анодні та катодні процеси мають загальну назву – електродні процеси.
Сумарна окисно-відновна реакція, рівняння якої одержують, складаючи ліві частини анодного та катодного процесів та їх праві частини, називається струмоутворюючою реакцією.
Анод є негативним електродом ГЕ, оскільки він постачає електрони у зовнішнє коло, а катод – позитивним електродом. Електродний потенціал анода менший за електродний потенціал катода:
φ анода < φ катода
Напрямлений потік електронів, які рухаються від анода до катода у зовнішньому колі, і є електричний струм.
Замикає електричне коло ГЕ рух йонів у розчині (внутрішнє коло).
Умовою роботи ГЕ є просторове розділення процесу окиснення та процесу відновлення, яке здійснюється завдяки наявності пористої перегородки між розчинами електролітів. У випадку її відсутності учасники анодного процесу передають електрони не у зовнішнє коло, а безпосередньо учасникам катодного процесу у розчині, внаслідок чого хімічна енергія перетворюється на теплову, а не на електричну.
Кількісною характеристикою роботи ГЕ є його електрорушійна сила Е.
Електрорушійна сила гальванічного елемента – це різниця між рівноважними електродними потенціалами.
Під час руху електронів у зовнішньому колі виконується максимальна корисна електрична робота Ак:
Ак= nFE (10.1)
де n – кількість електронів, що беруть участь у струмоутворюючій реакції, моль; F – стала Фарадея (F =96,5  ); E – електрорушійна сила ГЕ, В.
); E – електрорушійна сила ГЕ, В.
В свою чергу корисна робота здійснюється за рахунок зменшення енергії Гіббса струмоутворюючої реакції:
Ак= – ΔG (10.2)
З виразів (10.1) та (10.2) випливає:
ΔG = – nFE (10.3)
Аналізуючи цей вираз, можна зробити висновок, що ΔG < 0, якщо Е > 0, тобто, якщо електрорушійна сила гальванічного елемента – величина додатна.
Тому для розрахунку електрорушійної сили ГЕ потрібно від електродного потенціалу катода віднімати електродний потенціал анода:
Е = φ катода – φ анода > 0 (10.4)
У схемі окремого електрода зліва від вертикальної риси вказують речовини у розчині, які беруть участь в електродному процесі, а справа – матеріал електрода. Поряд записують рівняння рівноважного електродного процесу:
склад розчину | матеріал електрода, Ox + n·e–  Red,
Red,
де Ox – окиснена форма учасника електродного процесу, Red – її відновлена форма.
Електродний потенціал, який виникає на межі поділу між електродом та електролітом, залежить:
- від природи електрода та електроліту,
- від температури Т,
- від парціального тиску тої газуватої речовини, яка бере участь в електродному процесі, р,
- від концентрації учасників електродного процесу у розчині.
За стандартних умов, тобто, якщо:
- Т=298 К,
- парціальний тиск газуватої речовини р=101,3 кПа (умовна одиниця),
- концентрація учасників електродного процесу у розчині 1 моль/л,
електродний потенціал називається стандартним і позначається φ0.
За умов, що відрізняються від стандартних, електродні потенціали
розраховують за рівнянням Нернста:
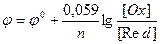 (10.5)
(10.5)
де n – кількість електронів в електродному процесі;
[Ox] та [Red] – концентрації окисненої та відновленої форм учасника електродного процесу.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1428; Нарушение авторских прав?; Мы поможем в написании вашей работы!