
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катодні процеси
Електроліз
Електроліз – це окисно-відновний процес, що відбувається на електродах під час проходження постійного електричного струму крізь розчин або розплав електроліту. Цей процес супроводжується перетворенням електричної енергії у хімічну.
Для проведення електролізу електроди занурюють у розплав або розчин електроліту і з`єднують їх з джерелом постійного електричного струму. Прилад, в якому проводять електроліз, називається електролізером або електролітичною ванною. Електролізу піддаються розчини та розплави солей, лугів та кислот.
На катоді, тобто на електроді, який з’єднаний з негативним полюсом джерела струму, відбувається процес відновлення. До катода (негативного електрода) рухаються позитивно заряджені йони (катіони): в розчинах кислот – це йони гідрогену Н+, в розплавах солей металів та лугів – це йони металів Меn+.
Під час електролізу водних розчинів кислот на катоді відновлюються йони гідрогену:
2Н+ + 2ē = Н20,
а в розплавах солей та лугів відновлюються йони металів:
Меn+ + nē = Me0.
Під час електролізу водних розчинів солей та лугів в катодному процесі можуть брати участь, окрім йонів металу, молекули води або йони гідрогену. Отже, на катоді в цьому випадку можливі такі процеси:
- відновлення йонів металу:
Меn+ + nē = Me0. (13.1)
Цей процес відбувається за потенціалу, що дорівнює потенціалу металічного електрода φ Меn+/Ме (Табл. Д.6).
- відновлення атомів гідрогену молекул води у нейтральному та лужному розчинах або йонів гідрогену у кислому розчині:
2Н+ОН + 2ē = Н20 + 2ОН-; (рН≥7) (13.2)
2Н+ + 2ē = Н20. (рН<7) (13.3)
Потенціал цього процесу залежить від концентрації йонів гідрогену у розчині, тобто від рН розчину, і розраховується за рівнянням Нернста для водневого електрода (10.8):
φ Н+/Н2 = – 0,059рН
Зробити висновок, які саме частинки відновлюються на катоді, можна, порівнюючи електродні потенціали цих процесів і враховуючи, що на катоді відбувається той процес, електродний потенціал якого більший. Нижче наведені правила визначення продуктів електролізу водних розчинів солей металів та лугів на катоді:
1. Якщо у розчині знаходяться йони металу, електродний потенціал якого більший за потенціал водневого електрода (φ0 Меn+/Ме>φ0 Н+/Н2), то на катоді відновлюються йони металу (13.1):
Меn+ + nē = Me0
До таких йонів належать йони Сu2+, Ag+, Hg2+, Au3+, Pt2+ тощо, тобто йони тих металів, які за значеннями електродних потенціалів у таблиці Д.6 розміщені після водневого електрода.
2. Якщо потенціал металічного електрода значно менший за потенціал водневого електрода (φ0 Меn+/Ме<<φ0 Н+/Н2), то на катоді відновлюються в залежності від рН розчину або атоми гідрогену, що знаходяться у складі молекул води (13.2), або йони гідрогену (13.3):
2Н+ОН + 2ē = Н20 + 2ОН–;
2Н+ + 2ē = Н20
Отже, на катоді утворюється водень, а йони металу залишаються у розчині. До таких металів належать метали, які розміщенні на початку таблиці Д.6, а саме, від літію до алюмінію включно.
Атоми гідрогену молекул води відновлюються на катоді в таких випадках:
– під час електролізу розчинів лугів, наприклад, розчинів NaOH, KOH (pH>7),
– під час електролізу розчинів хлоридів, нітратів, сульфатів лужних та лужно-земельних металів. Такі солі не піддаються гідролізу і їх розчини є нейтральними (рН=7).
Солі інших металів, окрім лужних та лужно-земельних, утворені слабкими основами, гідролізують, внаслідок чого їх розчини набувають кислої реакції (рН<7). Тому під час електролізу цих солей на катоді відновлюються йони Н+.
3. Йони металу, електродний потенціал якого більший за потенціал алюмінію, але менший за потенціал водневого електрода:
φ0 Al3+/Al < φ0 Меn+/Ме < φ0 Н+/Н2 ,
відновлюються на катоді одночасно з йонами Н+:
Меn+ + nē = Me0
2Н+ + 2ē = Н20
До таких йонів належать йони тих металів, які за значеннями електродних потенціалів розміщені у таблиці Д.6 між алюмінієм та водневим електродом, тобто йони Zn2+, Cr3+, Fe2+, Cd2+, Co2+, Ni2+ та інші.
Це пояснюється тим, що за певних умов електролізу, тобто за певних концентрацій йонів Меn+ та йонів Н+ у розчинах, потенціали їх відновлення зближуються. Тому на катоді утворюється шар металу і одночасно виділяється водень. Внаслідок гідролізу таких солей їх розчини набувають кислої реакції (рН<7). Тому на катоді відновлюються йони Н+, а не атоми гідрогену молекул води.
Розглянуті правила об’єднуємо на такому малюнку:
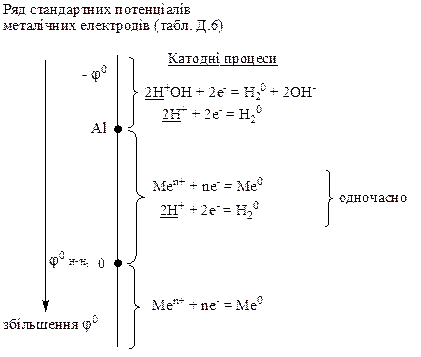
|
|
Дата добавления: 2015-05-23; Просмотров: 468; Нарушение авторских прав?; Мы поможем в написании вашей работы!