
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кількісні характеристики процесу дисоціації 3 страница
|
|
|
|
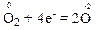
Приєднання атомом електронів називається відновленням, а сам атом та речовина, яка містить такий атом, – окисником.
Окисником в цій реакції є проста речовина кисень. Атоми-окисники, тобто атоми оксигену, відновлюються і їх ступінь окиснення понижується від “0” до “-2”.
Окисник є окисненою формою (Ох) речовини, яка під час перебігу реакції перетворюється у її відновлену форму (Red).
В цій реакції окиснена форма оксигену, тобто кисень, перетворюється у відновлену форму – алюміній оксид, в якій атоми оксигену набувають ступеня окиснення “-2”.
Будь-яку окисно-відновну реакцію можна охарактеризувати такою схемою:
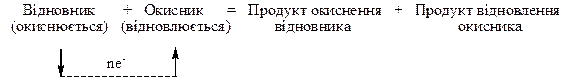
Якщо позначити відновлену та окиснену форми однієї речовини – Red (I) та Ox (I), а іншої речовини – Red (II) та Ox (II), то схема окисно-відновної реакції має вигляд:
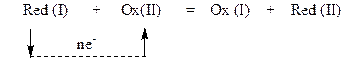
Треба пам’ятати, що ступінь окиснення атомів елемента в окисненій формі (Ox) більший за ступінь окиснення – у його відновленій формі (Red).
Коефіцієнти в рівняннях окисно-відновних реакцій розставляють за правилом електронного балансу: “Число електронів, що віддають всі атоми відновника, має дорівнювати числу електронів, що приєднують всі атоми окисника.”
Процеси окиснення та відновлення в окисно-відновних реакціях, тобто і в реакції, яка розглядається як приклад, зображують у вигляді електронних схем:
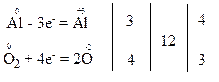
За правилом електронного балансу знаходимо коефіцієнти біля відновника та окисника: перед атомом алюмінію в простій речовині коефіцієнт дорівнює 4, а перед молекулою кисню – 3.
Отже, чотири атоми Al віддають 12 електронів, а три молекули O2 приєднують ці 12 електронів.
Крім того, число атомів одного і того ж елемента у вихідних речовинах і в продуктах реакції має бути однаковим. Тому із зіставлення числа атомів алюмінію та оксигену у лівій і правій частинах рівняння знаходимо, що утворюється 2 молекули алюміній оксиду.
Остаточне рівняння реакції:
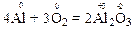
Правила, які дозволяють визначити, які речовини виявляють властивості тільки окисників, тільки відновників або як окисників, так і відновників:
1. Атоми елементів з найвищим ступенем окиснення здатні лише понижувати свій ступінь окиснення, тобто тільки приєднувати електрони. Такі атоми та речовини, у складі яких вони містяться, виявляють властивості тільки окисників.
2. Атоми елементів з найнижчим ступенем окиснення здатні лише підвищувати свій ступінь окиснення, тобто тільки віддавати електрони. Такі атоми та речовини, у складі яких вони містяться, виявляють властивості тільки відновників.
3. Атоми елементів з проміжним ступенем окиснення здатні і приєднувати, і віддавати електрони. Такі атоми та речовини, у складі яких вони містяться, можуть виявляти властивості як окисників, так і відновників.
Приклад 2. Виходячи зі ступеня окиснення атомів елементів, що підкреслені, та їх розташування в періодичній системі, визначте, які речовини виявлятимуть властивості тільки окисника, тільки відновника або як і окисника, так і відновника:
а) H I O4, H I, H I O;
б) Pb, Pb O2, Pb O.
Розв’язання. Розрахуємо ступінь окиснення атомів йоду та плюмбуму в наведених речовинах.
а)

+1+х+4·(-2)=0 +1+х=0 +1+х–2=0
х=+7 х=-1 х=+1
Елемент йод розташований в групі VII періодичної системи, отже, найвищим ступенем окиснення його атомів є “+7”. Тому атом йоду в молекулі HIO4 може лише понижувати свій ступінь окиснення, тобто тільки приєднувати електрони, наприклад:
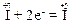
Отже, речовина HIO4 виявлятиме властивості тільки окисника.
Оскільки елемент йод належить до неметалів, то найнижчий ступінь окиснення його атомів є негативним і дорівнює “8 – номер групи періодичної системи”, а саме, “–1”. Тому атом йоду в молекулі HI здатний тільки віддавати електрони, підвищуючи свій ступінь окиснення, наприклад:
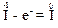
Отже, речовина HI виявлятиме властивості тільки відновника.
В молекулі HIO міститься атом йоду з проміжним ступенем окиснення, тому він здатний і віддавати, і приєднувати електрони, наприклад:
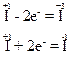
Тому речовина HIO виявлятиме властивості і відновника, і окисника.
б)
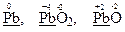
Елемент плюмбум виявляє металічні властивості, тому найнижчий ступінь окиснення його атомів дорівнює “0”. Отже, атоми плюмбуму в простій речовині свинець здатні тільки підвищувати свій ступінь окиснення, тобто тільки віддавати електрони., наприклад:
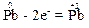
Тому проста речовина свинець виявлятиме властивості лише відновника.
Оскільки елемент плюмбум знаходиться в групі IV періодичної системи, то найвищий ступінь окиснення його атомів дорівнює “+4”. Тому атом плюмбуму в оксиді PbО2 здатний лише понижувати свій ступінь окиснення, тобто тільки приєднувати електрони, наприклад:
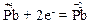
Отже, речовина PbО2 виступає тільки як окисник.
Ступінь окиснення атома плюмбуму в оксиді PbО є проміжним, отже, атом плюмбуму зі ступенем окиснення “+2” може і приєднувати, і віддавати електрони, наприклад:
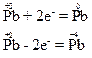
Тому речовина PbО виявлятиме властивості і відновника, і окисника.
Приклад 3. Виходячи зі ступеня окиснення атомів елементів, що підкреслені, та їх розташування в періодичній системі, визначте, чи можливі окисно-відновні реакції між наведеними в умові речовинами:
а) H Cl та K N O2;
б) Fe та N H3;
в) H3 As O4 та H2 Te O4
Розв’язання. Розрахуємо ступені окиснення атомів підкреслених елементів.
а)
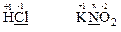
+1+х+2·(-2)=0, х=+3
Елемент хлор є неметалом і знаходиться в групі VII періодичної системи, тобто найнижчий ступінь окиснення його атомів є негативним і дорівнює “8 – номер групи”, а саме, “–1”. Отже, атом хлору в молекулі HCl може лише підвищувати свій ступінь окиснення, тобто тільки віддавати електрони. Тому речовина HCl є відновником.
Елемент нітроген розташований в групі V періодичної системи і теж належить до неметалів. Найвищий ступінь окиснення його атомів дорівнює “+5”, а найнижчий – “–3”. Отже, атом нітрогену з проміжним ступенем окиснення “+3” в молекулі KNO2 може і віддавати, і приєднувати електрони. Тому речовина KNO2 може бути і окисником, і відновником, але під час взаємодії з речовиною HCl, яка є відновником, виявляє властивості окисника.
Таким чином, між речовинами HCl та KNO2 окисно-відновна реакція можлива.
б)
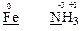
Ступінь окиснення атомів феруму в простій речовині залізо, що дорівнює “0”, є для металів найнижчим. Отже, атоми феруму здатні лише підвищувати свій ступінь окиснення, тобто тільки віддавати електрони, Тому проста речовина залізо виявляє властивості тільки відновника.
Ступінь окиснення атома нітрогену “–3” в молекулі NH3 теж є найнижчим, тобто цей атом може тільки віддавати електрони і речовина NH3 є теж тільки відновником.
Тому окисно-відновна реакція між речовинами Fe та NH3 неможлива.
в)
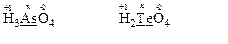
3·(+1)+х+4·(-2)=0 2·(+1)+х+4·(-2)=0
х=+5 х=+6
Оскільки ступені окиснення атомів арсену та телуру у сполуках чисельно дорівнюють номерам груп періодичної системи, в яких розташовані елементи, то розрахований ступінь окиснення атомів обох елементів є найвищим. Тому ці атоми здатні лише понижувати свої ступені окиснення, тобто тільки приєднувати електрони. Речовини, що містять ці атоми, виявляють властивості тільки окисників. Отже, окисно-відновна реакція між речовинами H3AsO4 та H2ТеO4 неможлива.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 529; Нарушение авторских прав?; Мы поможем в написании вашей работы!