
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кількісні характеристики процесу дисоціації 1 страница
|
|
|
|
Отже, обидва розчини киплять за однакової температури (100,52 0С) та замерзають за однакової температури (-1,86 0С).
9. Розчини електролітів
Електролітами називаються речовини, розплави та розчини яких проводять електричний струм. До електролітів належать кислоти, основи, амфотерні гідроксиди та солі.
Згідно з теорією електролітичної дисоціації електроліти під час розчинення дисоціюють на йони. Отже, електропровідність розчинів електролітів обумовлена наявністю у розчинах йонів, тобто розчини електролітів є йонними провідниками на відміну від електронних провідників, якими є метали.
Причиною дисоціації електроліту є його взаємодія з молекулами розчинника. Розчинник має бути полярним, а електроліт – йонною або полярною сполукою.
Під час розчинення йонної сполуки виникає взаємодія йонів електроліту, що знаходяться у вузлах кристалічної решітки, з полярними молекулами розчинника. Це призводить до вивільнення йонів з кристалічної решітки розчинюваної речовини і їх переходу у розчин. Під час розчинення полярної сполуки її молекули внаслідок взаємодії з полярними молекулами розчинника розщеплюються на йони.
У розчині йони електроліту оточені певною кількістю молекул розчинника, тобто існують у вигляді сольватованих йонів, а якщо розчинник – вода, то у вигляді гідратованих йонів.
Ступінь дисоціації розчиненої речовини a показує, яка частка розчинених молекул дисоціює на йони. Отже, ступінь дисоціації – це відношення концентрації продисоційованих молекул до концентрації розчинених молекул речовини:
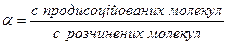 (9.1)
(9.1)
Ступінь дисоціації набуває значень від нуля до одиниці, або у відсотках – від 0 до 100%, тобто 0≤a≤1.
Ступінь дисоціації залежить від природи розчиненої речовини.
Якщо розчинена речовина є неелектролітом, тобто не дисоціює на йони, то a=0.
Електроліти за величиною ступеня дисоціації поділяють на сильні та слабкі.
Сильні електроліти дисоціюють на йони повністю, тобто концентрація продисоційованих молекул електроліту дорівнює концентрації розчинених молекул. Отже, ступінь дисоціації сильних електролітів становить 1 або 100% незалежно від їх концентрації.
Процес дисоціації сильного електроліту є необоротним: у розчині існують тільки йони, на які продисоціювали всі розчинені молекули електроліту.
Прикладом дисоціації сильного електроліту є дисоціація нітратної кислоти:
HNO3 = H+ + NO3– (9.2)
Слабкі електроліти дисоціюють на йони частково, тобто концентрація продисоційованих молекул електроліту менша за концентрацію розчинених молекул. Отже, ступінь дисоціації слабких електролітів менший за одиницю (α<1). У розчині слабкого електроліту встановлюється рівновага між недисоційованими молекулами електроліту та йонами, на які продисоціювала частина розчинених молекул. Процес дисоціації слабкого електроліту є оборотним: одночасно відбувається і дисоціація молекул на йони, і утворення молекул з йонів. Прикладом дисоціації слабкого електроліту є дисоціація ацетатної кислоти:
СН3СООН  Н+ + СН3СОО– (9.3)
Н+ + СН3СОО– (9.3)
Ступінь дисоціації слабких електролітів залежить від температури та їх концентрації у розчині.
Процес дисоціації у більшості є ендотермічним, тому за принципом Ле Шательє підвищення температури зміщує рівновагу у напрямку процесу дисоціації. Отже, ступінь дисоціації слабких електролітів за нагрівання збільшується.
За розбавляння розчину слабкого електроліту, тобто зі зменшенням концентрації електроліту у розчині, зменшується вірогідність зіткнення йонів, що утруднює утворення молекул. Отже, розбавляння розчину слабкого електроліту зміщує рівновагу у напрямку процесу дисоціації і ступінь його дисоціації збільшується.
Ступінь дисоціації розчиненої речовини залежить і від природи розчинника. Так, речовина НCl у водному розчині є сильним електролітом, а бензольний розчин НCl не проводить електричний струм, тобто молекули НCl у цьому розчині не дисоціюють на йони.
Константа дисоціації – це константа рівноваги оборотного процесу дисоціації слабкого електроліту. Так, для процесу дисоціації ацетатної кислоти (9.3) вираз її константи дисоціації має такий вигляд:
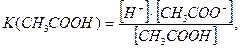 (9.4)
(9.4)
де [H+], [CH3COO-] – рівноважні концентрації йонів, а [CH3COOH] – рівноважна концентрація недисоційованих молекул кислоти.
Константа дисоціації електроліту залежить від природи електроліту та температури, але, як і будь-яка константа рівноваги, не залежить від концентрації електроліту у розчині. Тому точніше сила електроліту оцінюється не за ступенем дисоціації, який залежить від концентрації електроліту, а за значенням константи дисоціації.
Чим слабкішим є електроліт, тим меншою є концентрація йонів у розчині, отже, меншим є і значення константи дисоціації електроліту.
Так, константа дисоціації ціанідної кислоти (K (HCN) = 8×10-10) менша за константу дисоціації ацетатної кислоти (К (СН3СООН) = 1,8×10-5). Отже, ціанідна кислота є більш слабким електролітом, ніж ацетатна.
Між константою дисоціації та ступенем дисоціації слабкого електроліту існує зв’язок. Так, для електроліту, який дисоціює на два йони, наприклад, для ацетатної кислоти (9.3) з концентрацією у розчині с та ступенем дисоціації a концентрація продисоційованих молекул, отже, і концентрація йонів, на які дисоціюють молекули, дорівнюють (9.1):
с продисоційованих молекул = [H+] = [CН3СОО–] = ac,
a концентрація недисоційованих молекул кислоти становить:
[CH3COOH] = с – ac.
Тоді константа дисоціації кислоти має вигляд:
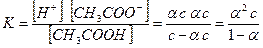 (9.5)
(9.5)
Якщо електроліт є дуже слабким, тобто a<<1, то вираз (9.5) спрощується:
К = a2 с (9.6)
Вираз (9.5) та (9.6) є математичним виразом закону розбавляння, згідно з яким за розбавляння розчину, тобто зі зменшенням концентрації слабкого електроліту, його ступінь дисоціації збільшується, а константа дисоціації залишається незмінною.
Оскільки дисоціація сильного електроліту є процесом необоротним і у розчині недисоційовані молекули електроліту не існують, то константа дисоціації сильних електролітів позбавлена фізичного змісту.
Класифікація електролітів за характером утворених йонів
Кислоти – це електроліти, під час дисоціації яких у якості катіонів утворюються тільки йони гідрогену Н+.
З найважливіших кислот до сильних електролітів належать такі кислоти: H2SO4, HNO3, HCl, HBr, HI, HСlO4, HMnO4.
Сильні кислоти дисоціюють на йони повністю та необоротно за схемою (9.2).
Дисоціація слабких кислот – процес оборотний, а якщо кислота багато- основна, то і ступінчастий, наприклад, дисоціація карбонатної кислоти:
H2CO3  H++HCO3- (перший ступінь)
H++HCO3- (перший ступінь)
HCO3-  H++CO32- (другий ступінь)
H++CO32- (другий ступінь)
Кожний ступінь характеризується певним значенням константи дисоціації:

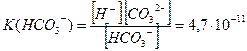
Порівняння цих значень (К(НСО3-) < К(Н2СО3)) вказує на те, що йони НСО3- є більш слабким електролітом, ніж молекули Н2СО3. Отже, дисоціація Н2СО3 більшою мірою відбувається за першим ступенем і значно меншою – за другим. Тому у водному розчині поряд з молекулами Н2СО3 є йони Н+, НСО3- і у меншій кількості йони СО32-
Основи – це електроліти, під час дисоціації яких у якості аніонів утворюються тільки гідроксид-йони ОН–.
Сильними електролітами є розчинні у воді основи (луги), тобто основи, утворені лужними та лужно-земельними металами: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Їх дисоціація є процесом необоротним, наприклад, дисоціація натрій гідроксиду та кальцій гідроксиду:
NaOH = OH– + Na+
Ca(OH)2 = 2OH– + Ca2+
Розчинний у воді амоній гідроксид є слабким електролітом і дисоціює на йони оборотно:
NH4OH  OH– + NH4+
OH– + NH4+
Основи інших металів, крім лужних та лужно-земельних, мало розчиняються у воді. Дисоціює на йони лише та частина речовини, яка знаходиться у розчині. Якщо основа містить у своєму складі декілька груп ОН, то дисоціація відбувається ступінчасто, наприклад, дисоціація купрум (ІІ) гідроксиду:
Cu(OH)2  OH– + CuOH+ (перший ступінь)
OH– + CuOH+ (перший ступінь)
CuOH+  OH– + Cu2+ (другий ступінь)
OH– + Cu2+ (другий ступінь)
Отже, малорозчинний у воді гідроксид Cu(OH)2 знаходиться у рівновазі з розчином, в якому містяться йони ОН–, CuOH+ та у меншій кількості йони Cu2+, оскільки дисоціація Cu(OH)2 за другим ступенем відбувається меншою мірою, ніж за першим.
Амфотерні гідроксиди – це електроліти, під час дисоціації яких утворюються одночасно і йони Н+, і йони ОН–. До амфотерних гідроксидів належать такі малорозчинні у воді гідроксиди: Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 тощо.
Амфотерні гідроксиди, наприклад, берилій гідроксид, здатні виявляти і основні властивості, зумовлені утворенням йонів ОН– під час ступінчастої дисоціації:
Ве(OH)2  OH– + ВеOH+,
OH– + ВеOH+,
і кислотні властивості, дисоціюючи з утворенням йонів Н+:
H2ВеO2  H+ + HВеO2–.
H+ + HВеO2–.
Солі – це електроліти, під час дисоціації яких утворюються катіони залишків основ і аніони кислотних залишків.
Розчинні у воді середні солі дисоціюють на йони повністю, тобто поводять себе як сильні електроліти. Наприклад, амоній сульфат та магний хлорид дисоціюють за такими рівняннями:
(NH4)2SO4 = 2NH4+ + SO42–,
MgCl2 = Mg2+ + 2Cl–
Кислі солі у більшості розчинні у воді і дисоціюють на йони ступінчасто. Спочатку повністю відщеплюються катіони металу, а потім, аніон кислотного залишку дисоціює частково, як слабкий електроліт, з утворенням йонів Н+. Наприклад, дисоціація калій гідрогенсульфіту описується наступною схемою:
KHSO3 = K+ + HSO3- (перший ступінь)
HSO3–  H+ + SO32– (другий ступінь)
H+ + SO32– (другий ступінь)
Основні солі є малорозчинними у воді сполуками і та частина солі, що знаходиться у розчині, дисоціює на йони також ступінчасто: спочатку відщеплюються аніони кислотних залишків, а потім – йони ОН–. При цьому між нерозчинною основною сіллю та йонами у розчині встановлюється рівновага. Прикладом дисоціації основної солі є дисоціація гідроксостанум (II) хлориду:
SnOHCl  Cl– + SnOH+ (перший ступінь)
Cl– + SnOH+ (перший ступінь)
SnOH+  OH– + Sn2+ (другий ступінь)
OH– + Sn2+ (другий ступінь)
Дисоціація води
Вода, як дуже слабкий електроліт, дисоціює на йони Н+ та ОН– частково (з 550000000 молекул дисоціює тільки одна):
Н2О  Н+ + ОН–
Н+ + ОН–
Константа дисоціації води за температури 220С становить:
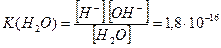 (9.7)
(9.7)
де [H+], [OH–], [H2O] - рівноважні концентрації відповідно йонів Н+, ОН– та недисоційованих молекул води. Оскільки вода дисоціює на йони незначною мірою, то концентрацію недисоційованих молекул можна вважати такою, що дорівнює загальній молярній концентрації води (7.4):
[H2O]=с(H2O)= 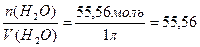 моль/л,
моль/л,
де кількість води об′ємом 1 л і масою 1000 г дорівнює (1.7):
n(H2O)= 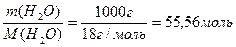 .
.
Підставляючи концентрацію води у вираз константи дисоціації води (9.7), одержуємо:
[H+]×[OH–] = 1,8×10–16 × 55,56 = 10–14 (9.8)
Добуток концентрацій йонів Н+ і ОН– у воді називається йонним добутком води і позначається Кв. Йонний добуток води залежить від температури, але за сталої температури Кв, як і будь-яка константа рівноваги, не залежить від концентрації йонів Н+ та ОН–. Це означає, що зі збільшенням концентрації одного з йонів відповідно зменшується концентрація іншого йону, а величина Кв залишається незмінною. Оскільки користуватись числами з від’ємними показниками степеня незручно, тому вираз (9.8) логарифмуємо:
lg[H+] + lg[OH–] = –14
Змінюємо знаки на протилежні:
-lg[H+] -lg[OH-] = 14 (9.9)
і вводимо поняття ”показник йонів гідрогену”, який позначається символом рН:
рН = – lg[H+] (9.10)
Отже, рН – це десятковий логарифм концентрації йонів гідрогену Н+, взятий з від’ємним знаком. Відповідно до рН існує поняття рОН:
рОН = – lg[OH-] (9.11)
З виразів (9.9, 9.10, 9.11) випливає:
рН + рОН = 14 (9.12)
Виходячи з виразів (9.10) та (9.11), можна розрахувати концентрації йонів Н+ та ОН–:
[H+] = 10–pH, (9.13)
[OH–] = 10–pОH. (9.14)
В залежності від співвідношення концентрацій йонів Н+ і ОН– та, користуючись виразами (9.8) та (9.12), розрізняють нейтральні, кислі та лужні розчини.
У нейтральному розчині:
[H+]=[OH–] =10-7 моль/л, а рН=рОН=7
У кислому розчині:
[H+]>[OH–], тобто [H+]>10-7 моль/л, а рН<7, відповідно рОН>7.
У лужному розчині:
[H+]<[OH–], тобто [H+]<10-7 моль/л, а рН>7, відповідно рОН<7.
Наочно залежність між значеннями рН і реакцією розчину можна виразити схемою:
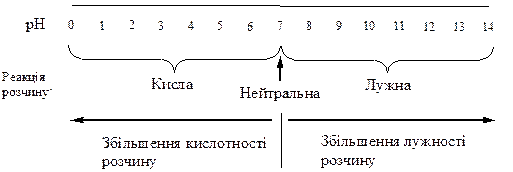
Отже, чим менша величина рН, тим більшою є концентрація йонів Н+ у розчині і вища кислотність розчину. І, навпаки, чим більше значення рН, тим меншою є концентрація йонів Н+ у розчині, тобто вища лужність розчину.
Приклад 1. Розрахуйте концентрацію йонів Н+ та ОН- у розчині, рН якого становить 3. Яку реакцію має розчин?
Розв'язання.
Розрахуємо значення рОН (9.12):
рОН=14–рН=14–3=11
Обчислимо концентрації йонів Н+ та ОН– (9.13), (9.14):
[H+] = 10–pH = 10–3 моль/л,
[OH–] = 10–pОH = 10–11 моль/л.
Розчин є кислим, тому що концентрація йонів Н+ у розчині більша за концентрацію йонів ОН– ([H+]>[OH–]), а рН<7.
Приклад 2. Розрахуйте рН та рОН розчину хлоридної кислоти з концентрацією HCl у розчині с(HCl)=0,1 моль/л.
Розв'язання.
Хлоридна кислота є сильним електролітом, тобто дисоціює на йони у розчині повністю (a = 1): HCl = Н+ + Cl–.
Тому концентрація йонів Н+ дорівнює молярній концентрації HCl у розчині (9.1):
[H+] = a с(HCl) = 0,1 моль/л.
Розрахуємо значення рН та рОН розчину (9.10), (9.12):
рН = –lg[H+] = –lg0,1 = 1
рОН = 14 – рН = 14–1 = 13.
Приклад 3. Розрахуйте рН розчину слабкої одноосновної кислоти НА та її константу дисоціації, якщо концентрація кислоти с(НА)=0,01 моль/л, а ступінь її дисоціації a=0,1% (0,001).
Розв'язання.
Слабкий електроліт дисоціює на йони частково, тобто процес дисоціації НА є оборотним:
НА  Н++А-
Н++А-
Розрахуємо концентрацію продисоційованих молекул кислоти (9.1):
с продисоц. молекул = a с(НА) = 0,001×0,01 = 10–5 моль/л
Концентрація йонів Н+ дорівнює концентрації продисоційованих молекул НА:
[H+] = 10–5 моль/л
Обчислюємо рН розчину (9.10):
рН = –lg[H+] = –lg10–5 = 5
Розрахуємо значення константи дисоціації кислоти (9.6):
К = a2 с(НА) = (10–3)2×0,01 = 10-8.
Приклад 4. Розрахуйте рН та рОН розчину об’ємом 0,25 л, в якому міститься натрій гідроксид масою 0,1 г.
Розв'язання.
Розрахуємо молярну концентрацію натрій гідроксиду у розчині (7.4):
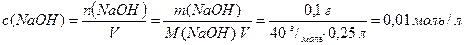
Натрій гідроксид є сильним електролітом і дисоціює на йони у розчині повністю (a = 1):
NaOH = OH– + Na+
Тому концентрація йонів OH- дорівнює молярній концентрації натрій
гідроксиду (9.1):
[OH–] = a c(NaOH) = 0,01 моль/л.
Визначаємо рОН розчину (9.11):
pOH = –lg[OH–] = –lg10–2 =2
Значення рН розчину та концентрація йонів Н+ дорівнюють (9.12), (9.13):
pН = 14 – pOH = 14 – 2 = 12;
[H+] = 10–pH = 10–12 моль/л.
Приклад 5. Розрахуйте константу та ступінь дисоціації слабкої основи ХОН з концентрацією основи у розчині с(ХОН)=0,5 моль/л. Значення рН розчину дорівнює 11.
Розв'язання.
Визначимо рОН розчину та концентрацію йонів ОН– у розчині (9.12), (9.14):
рОН = 14 – рН = 14 – 11 = 3
[OH–] = 10–рОН = 10–3 моль/л.
Слабка основа дисоціює на йони частково і концентрація йонів ОН– дорівнює концентрації продисоційованих молекул ХОН:
ХОН  ОН– + Х+
ОН– + Х+
с продисоц. молекул ХОН = [OH–] = 10–3 моль/л
Розрахуємо ступінь дисоціації основи (9.1):
a 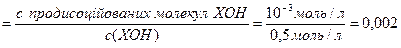
Обчислимо константу дисоціації основи (9.6):
К = a2 с(ХОН) = 0,0022×0,5 = 2×10–6.
Приклад 6. Обчисліть ступінь дисоціації амоній гідроксиду та рН двох розчинів з концентраціями NH4OH: с1(NH4OH) = 0,5 моль/л та с2(NH4OH) = 0,05 моль/л. Костанта дисоціації амоній гідроксиду дорівнює К=1,8·10–5. Як впливає концентрація електроліту у розчині на ступінь його дисоціації?
Розв'язання.
За виразом (9.6) розрахуємо ступінь дисоціації амоній гідроксиду у розчинах:
a1 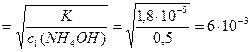
a2 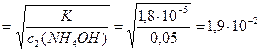
Отже, за зменшення концентрації NH4OH у 10 разів, тобто за розбавляння розчину, ступінь його дисоціації збільшився приблизно у 3 рази.
Розрахуємо концентрацію йонів ОН– (9.1):
[OH–]1=a1c1(NH4OH)=6·10–3·0,5 моль/л=3·10–3 моль/л,
[OH–]2=a2c2(NH4OH)=1,9·10–2·0,05 моль/л=9,5·10–4 моль/л,
Обчислимо значення рОН (9.11) та рН (9.10) розчинів:
pOH1 = –lg[OH–]1 = –lg3·10–3 =2,52,
pН1=14 – pOH1=14 – 2,52=11,48;
pOH2 = –lg[OH–]2 = –lg9,5·10–4=3,02,
pН2=14 – pOH2=14 – 3,02=10,98;
Реакції обміну в розчинах електролітів
Правила складання йонно-молекулярних рівнянь реакцій:
- Сильні кислоти, сильні основи та розчинні у воді солі записують у вигляді йонів, оскільки вони у розчинах повністю дисоціюють на йони.
- Малодисоційовані сполуки, до яких належать слабкі електроліти, практично нерозчинні (малорозчинні) та леткі речовини, записують у вигляді молекул, тому що вони у розчинах дисоціюють на йони дуже незначною мірою. Малорозчинні та практично нерозчинні у воді сполуки в таблиці Д.5 позначені буквами „м” та „н”.
Приклад 6. Розглянемо реакції, внаслідок перебігу яких утворюються слабкі електроліти, на прикладі взаємодії у розчині між нітратною кислотою та калій гідроксидом.
Складаємо рівняння реакції у молекулярному вигляді:
HNO3 + KOH = KNO3 + H2O
У повному йонно-молекулярному рівнянні реакції сильну кислоту HNO3, сильну основу KOH та розчинну у воді середню сіль KNO3 записуємо у вигляді йонів, а слабкий електроліт Н2О – у вигляді молекул:
Н+ + NO 3– + K+ + OH– = K+ + NO 3– + H2O
Виключаємо з обох частин рівняння однакові йони, тобто йони, що не беруть участь в реакції (вони підкреслені). Записуємо скорочене йонно-молекулярне рівняння реакції:
Н+ + ОН– = Н2О
Реакція фактично зводиться до взаємодії йонів Н+ з йонами ОН– з утворенням молекул Н2О. Ця реакція є практично необоротною, тобто відбувається у напрямку зв’язування йонів в молекули слабкого електроліту, яким є вода.
Приклад 7. Розглянемо реакції, внаслідок перебігу яких утворюються нерозчинні у воді сполуки, на прикладі взаємодії у розчинах:
а) між арґентум нітратом та хлоридною кислотою;
б) між цинк хлоридом та натрій гідроксидом.
Складаємо рівняння цих реакцій у молекулярному вигляді:
а) AgNO3 + HCl = AgCl¯ + HNO3 ,
б) ZnCl2 + 2NaOH = Zn(OH)2¯ + 2NaCl
В наведених реакціях арґентум хлорид та цинк гідроксид є нерозчинними у воді сполуками, тому їх записуємо у вигляді молекул. Всі інші сполуки, а саме, розчинні у воді середні солі AgNO3, ZnCl2, NaCl, сильні кислоти HCl та HNO3, сильну основу NaOH записуємо у вигляді йонів:
а) Ag+ + NO 3– + H + + Cl– = AgCl + H + + NO 3– ,
б) Zn2+ + 2Cl – + 2Na + + 2OH– = Zn(OH)2 + 2Na + + 2Cl –
Виключаючи однакові йони з обох частин рівнянь, можна зробити висновок, що фактично реакція а) відбувається між йонами Ag+ та Cl–; реакція б) зводиться до взаємодії йонів Zn2+ з йонами ОН–, а решта йонів участь в реакціях не бере:
а) Ag+ + Cl– = AgCl,
б) Zn2+ + 2OH– = Zn(OH)2
Отже, ці реакції є практично необоротними і відбуваються у напрямку зв’язування йонів у нерозчинні у воді сполуки AgCl та Zn(OH)2.
Приклад 8. Прикладом реакцій, внаслідок перебігу яких утворюються леткі речовини, є реакція взаємодії калій сульфіду з хлоридною кислотою, яка відбувається у розчині за рівнянням:
K2S + 2HCl = 2KCl + H2S↑
Розчинні у воді середні солі K2S та KCl, сильну кислоту HCl записуємо у вигляді йонів, а летку речовину сірководень Н2S – у вигляді молекул:
2K + + S2– + 2H+ + 2Cl – = 2K + + 2Cl – + H2S
Скорочене йонно-молекулярне рівняння реакції одержуємо після виключення однакових йонів з обох частин рівняння:
2H+ + S2– = H2S
Реакція є практично необоротною і відбувається у напрямку зв’язування йонів в молекули леткої речовини H2S.
Приклад 9. Зміщення рівноваги в розчинах електролітів розглянемо на прикладі таких реакцій.
а) Реакція взаємодії нітритної кислоти НNO2 з калій гідроксидом у розчині відбувається за рівнянням:
HNO2 + KOH  KNO2 + H2O
KNO2 + H2O
У вигляді молекул запишемо нітритну кислоту та воду, тому що це слабкі електроліти, а сильну основу KOH та розчинну у воді середню сіль КNO2 – у вигляді йонів:
HNO2 + K + + OH–  K + + NO2– + H2O
K + + NO2– + H2O
Виключаємо з обох частин рівняння йони К+, які не беруть участь в реакції, і записуємо скорочене йонно-молекулярне рівняння реакції:
HNO2 + OH–  NO2– + H2O
NO2– + H2O
Ця реакція є оборотною: пряма реакція відбувається у напрямку утворення слабкого електроліту Н2О, а зворотна – у напрямку утворення слабкого електроліту HNO2. Але вода є більш слабким, тобто менш дисоційованим електролітом (К(H2O)=1,8×10-16), ніж нітритна кислота (К(HNO2)=4×10-4). Отже, зв’язування йонів Н+ в молекули Н2О відбувається більш повною мірою, ніж в молекули HNO2. Тому рівновага реакції зміщена у напрямку утворення більш слабкого електроліту, яким є H2O.
б) Кисла сіль калій гідрогенкарбонат реагує з натрій гідроксидом, як кислота, утворюючи середні солі – калій карбонат та натрій карбонат:
2KHCO3 + 2NaOH  K2CO3 + Na2CO3 + 2H2O
K2CO3 + Na2CO3 + 2H2O
Розчинна у воді кисла сіль KHCO3 за першим ступенем дисоціює на йони K+ та HCO3– повністю, а йон HCO3– дисоціює частково, тобто є слабким електролітом. Враховуючи, що HCO3– та Н2О є слабкими електролітами, NaOH – сильна основа, а середні солі K2CO3 і Na2CO3 – розчинні у воді, записуємо йонно-молекулярне рівняння реакції у повному та скороченому вигляді:
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 3354; Нарушение авторских прав?; Мы поможем в написании вашей работы!