
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типи електродів
|
|
|
|
Металічний електрод – це металічна пластина, занурена у розчин солі цього металу.
Схема металічного електрода:
Men+ | Me, Men+ + ne–  Me0
Me0
У схемі зліва від вертикальної риси, якою позначають межу поділу між електродом та електролітом, вказують йони металу у розчині солі, а справа – метал електрода. Поряд наведено рівняння рівноважного електродного процесу, який відбувається на поверхні металу, де Men+ – окиснена форма металу (Ох), а Me0 – його відновлена форма (Red).
Враховуючи, що концентрація твердої речовини, тобто концентрація металу у вільному стані (Red) – величина стала, рівняння Нернста (10.5) для металічного електрода має такий вигляд:
 (10.6)
(10.6)
де n – кількість електронів в електродному процесі, яка чисельно збігається з зарядом йонів Men+, а [Men+] – концентрація йонів Men+ у розчині.
За стандартних умов:
- Т=298 К,
- [Men+]= 1 моль/л;
потенціал металічного електрода є стандартним:  .
.
Стандартні потенціали металічних електродів наведені в таблиці Д. 6.
До газових електродів належать електроди, на поверхні яких відбувається електродний процес за участю газуватої речовини.
У якості металічного провідника використовують платинову пластину з таких причин:
– платина – неактивний метал, тобто не приймає участі безпосередньо в електродному процесі;
– платина є каталізатором електродного процесу, тобто прискорює встановлення рівноваги електродного процесу на межі поділу між електродом та електролітом.
У водневому електроді пластина платини занурена у розчин сульфатної кислоти, через який продувають газ водень. На поверхні пластини, яка омивається воднем, відбувається адсорбція, тобто поглинання платиною молекул водню. Для збільшення площі поверхні і для покращення адсорбції пластину вкривають подрібненою губчастою платиною.
Схема водневого електрода:
H+ | H2, Pt, 2H+ + 2e–  H20
H20
Зліва від вертикальної риси вказані йони гідрогену Н+ у розчині сульфатної кислоти (H2SO4 = 2H+ + SO42–), справа – молекули Н2, які знаходяться на поверхні платини. Поряд наведено рівняння рівноважного електродного процесу, в якому окисненою формою гідрогену (Ох) є йони Н+, а відновленою (Red) – молекули Н2.
За рівнянням Нернста (10.5) потенціал водневого електрода дорівнює: 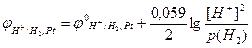
За стандартних умов:
- Т=298 К,
- парціальний тиск водню р(Н2)=101,3 кПа (умовна одиниця),
- концентрація йонів гідрогену [Н+]=1 моль/л, тобто рН розчину дорівнює 0;
потенціал водневого електрода є стандартним і умовно приймається за 0:

Якщо концентрація йонів гідрогену [Н+] ≠ 1 моль/л, то рівняння Нернста для водневого електрода має вигляд:
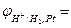 0,059lg[H+] (10.7)
0,059lg[H+] (10.7)
Враховуючи, що рН = – lg [H+], потенціал водневого електрода дорівнює:
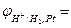 – 0,059рН (10.8)
– 0,059рН (10.8)
У кисневому електроді платинова пластина занурена у розчин лугу, через який продувають газ кисень. Молекули О2, що поглинаються поверхнею платини, знаходяться у рівновазі з йонами ОН– у розчині, які утворюються внаслідок дисоціації лугу (KOH=K+ + OH–).
Схема кисневого електрода:
OH– | O2, Pt, O20 + 4e– +2H2O  4OH–
4OH–
В рівнянні електродного процесу окисненою формою оксигену (Ох) є молекули О2, а відновленою (Red) – йони ОН–, в яких ступінь окиснення атомів оксигену дорівнює “-2”.
Рівняння Нернста для кисневого електрода:

За стандартних умов:
- Т=298 К,
- парціальний тиск кисню р(О2)=101,3 кПа (умовна одиниця),
- концентрація гідроксид-йонів у розчині [ОН–]=1 моль/л, тобто рОН розчину дорівнює 0, а рН=14;
потенціал кисневого електрода є стандартним і дорівнює (Табл. Д.7):
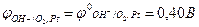
Якщо концентрація гідроксид-йонів [ОН–] ≠ 1 моль/л, то потенціал кисневого електрода розраховують за виразом:
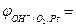 1,23 – 0,059рH (10.9)
1,23 – 0,059рH (10.9)
У хлорному електроді платинова пластина занурена у розчин солі калій хлориду KCl, через який продувають газ хлор.
Схема хлорного електрода:
Cl– | Cl2, Pt, Cl20 + 2e–  2Cl–
2Cl–
В рівнянні електродного процесу окисненою формою хлору (Ох) є молекули Cl2, а відновленою (Red) – йони Cl–, які утворюються у розчині внаслідок дисоціації солі (KCl=K+ + Cl–).
Рівняння Нернста (10.5) для хлорного електрода має такий вигляд:

За стандартних умов:
- Т=298 К,
- парціальний тиск хлору р(Cl2)=101,3 кПа (умовна одиниця),
- концентрація хлорид-йонів у розчині [Cl–]=1 моль/л;
потенціал хлорного електрода є стандартним і дорівнює (Табл. Д.7):

Окисно-відновні електроди (редокс-електроди) – це всі інші електроди окрім металічних та газових. Отже, в електродних процесах цих електродів не приймають безпосередньої участі метали та гази. В редокс-електродах за таких же причин, як і в газових, у якості металічного провідника використовують платинову пластину. У більшості ця пластина знаходиться у контакті з розчином, в якому міститься і окиснена (Ох), і відновлена (Red) форми учасника електродного процесу.
Прикладом редокс-електрода є платинова пластина, занурена у розчин суміші солей FeCl2 та FeCl3, які дисоціюють з утворенням йонів Fe2+ та Fe3+.
Схема цього редокс-електрода:
Fe3+, Fe2+ | Pt; Fe3+ + e–  Fe2+
Fe2+
Окисненою формою (Ох) є йони Fe3+, а відновленою (Red) – йони Fe2+. Рівняння Нернста для вказаного редокс-електрода має такий вигляд:
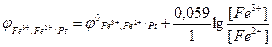
За стандартних умов:
- Т=298 К;
- концентрація йонів: [Fe3+]=1 моль/л та [Fe2+]=1 моль/л;
потенціал електрода є стандартним і дорівнює (Табл. Д.7):

У більш складних редокс-електродах в електродному процесі беруть участь, окрім окисненої та відновленої форм речовини, йони Н+ або ОН–. Прикладом є редокс-електрод, схема якого наведена нижче:
MnO4–, Mn2+, H+ | Pt, MnO4– + 5e– + 8H+  Mn2+ + 4H2O
Mn2+ + 4H2O
За рівнянням Нернста (10.5) потенціал такого редокс-електрода дорівнює:
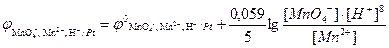
За стандартних умов:
- Т=298 К,
- [MnO4-]=1 моль/л, [Mn2+]=1 моль/л, [H+]=1 моль/л;
потенціал електрода є стандартним і дорівнює (Табл. Д.7):
 .
.
Вимірювання електродних потенціалів
Для того, щоб виміряти потенціал окремого електрода, тобто потенціал, який виникає на межі поділу між електродом та електролітом, потрібно приєднати до вимірювального приладу не тільки сам електрод, а і розчин електроліту. Для цього необхідно занурити у розчин електроліту металічний дріт, який в ту ж мить стає електродом. Таким чином, за вимірювальним приладом можна визначити тільки різницю між потенціалами двох електродів. Отже, абсолютне значення потенціалу окремого електрода виміряти неможливо.
Тому потенціал окремого електрода вимірюють відносно стандартного водневого електрода, тобто електрода, потенціал якого за стандартних умов вважають за 0. Для цього складають гальванічний елемент, в якому один з електродів є досліджуваний, а інший – стандартний водневий електрод.
Якщо потенціал досліджуваного електрода менший за потенціал стандартного водневого електрода, то досліджуваний електрод є анодом, а стандартний водневий – катодом.
Нижче наведена схема такого гальванічного елемента:
(Анод) досліджуваний електрод | електроліт || Н+ | H2, Pt (Катод)
“–” “+”
Електрорушійна сила ГЕ дорівнює:
Е = φ катода – φ анода = φ0 Н+ | H2, Pt – φ дослідж. електрода
Якщо потенціал досліджуваного електрода також є стандартним, то електрорушійна сила ГЕ називається стандартною і позначається Е0:
Е0 = φ0 Н+ | H2, Pt – φ0дослідж. електрода
Оскільки φ0 Н+ | H2, Pt = 0, тоді потенціал досліджуваного електрода дорівнює:
φ дослідж. електрода = – Е,
а стандартний потенціал досліджуваного електрода:
φ0дослідж. електрода = – Е0
Якщо потенціал досліджуваного електрода більший за потенціал стандартного водневого електрода, то досліджуваний електрод є катодом, а стандартний водневий електрод – анодом.
Схема гальванічного елемента:
(Анод) Pt, H2 | Н+ || електроліт | досліджуваний електрод (Катод)
“–” “+”
Електрорушійна сила такого ГЕ дорівнює:
Е = φ дослідж. електрода – φ0 Н+ | H2, Pt,
а його стандартна електрорушійна сила:
Е0 = φ0дослідж. електрода – φ0 Н+ | H2, Pt
В такому випадку потенціал досліджуваного електрода та його стандартний потенціал дорівнюють:
φдослідж. електрода = Е,
φ0дослідж. електрода = Е0
Отже, стандартний електродний потенціал – це виміряна за стандартних умов електрорушійна сила гальванічного елемента, який складається з досліджуваного електрода та водневого електрода.
Приклад 1. Складіть схему гальванічного елемента (ГЕ), в якому пластини алюмінію та міді занурені у розчини своїх солей з концентрацією йонів Al3+ та Cu2+, що дорівнює відповідно 0,001 та 0,1 моль/л.
Напишіть рівняння електродних процесів та струмоутворюючої реакції. Розрахуйте: а) електрорушійну силу ГЕ; б) зміну стандартної енергії Гіббса струмоутворюючої реакції ΔG0; в) стандартну енергію Гіббса утворення йонів Cu2+, якщо відомо, що стандартна енергія Гіббса утворення йонів Al3+ дорівнює: ΔG0(Al3+)= – 481 кДж/моль.
Розв’язання. Розрахуємо за рівнянням Нернста для металічних електродів (10.6) потенціали пластин алюмінію та міді:
 ,
,
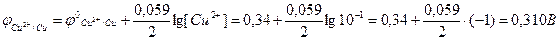
Оскільки  <
< 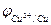 , то електрод з алюмінію є анодом, а з міді – катодом.
, то електрод з алюмінію є анодом, а з міді – катодом.
Схема ГЕ:
(Анод) Al | Al3+ || Cu2+ | Cu (Катод)
“–” “+”
На поверхні анода, тобто електрода з алюмінію, відбувається окиснення алюмінію (віддавання електронів атомами Al).
Рівняння анодного процесу:
Al – 3e– = Al3+ | 2
Електрони рухаються у зовнішньому колі від анода до катода. На поверхні катода, тобто електрода з міді, відбувається відновлення йонів купруму (приєднання електронів йонами Cu2+).
Рівняння катодного процесу:
Cu2+ + 2e– = Cu | 3
Рівняння сумарної, тобто струмоутворюючої реакції, одержуємо, складаючи рівняння електродних процесів, попередньо помноживши рівняння анодного процесу на 2, а катодного процесу – на 3:
2Al + 3Cu2+ = 2Al3+ + 3Cu
а) Розрахуємо електрорушійну силу ГЕ (11.4):
Е = φкатода – φанода = φ Cu2+ | Cu – φ Al3+ | Al = 0,310 – (–1,719) = 2,029 В
б) Обчислимо зміну стандартної енергії Гіббса струмоутворюючої реакції ΔG0 за виразом (10.3), який за стандартних умов має такий вигляд:
ΔG0 = – nFE0 , (10.10)
де n – кількість електронів, що приймають участь у струмоутворюючій реакції, дорівнює 6 моль (2 моль атомів Al віддають 6 моль електронів, які приєднують 3 моль йонів Cu2+),
E0 – стандартна електрорушійна сила ГЕ, яка дорівнює різниці стандартних електродних потенціалів:
Е0 = φ0 Cu2+ | Cu – φ0 Al3+ | Al = 0,34 – (–1,66) = 2 В
Отже,
ΔG0= – nFE0 = – 6 моль · 96,5  · 2 В = – 1158 кДж.
· 2 В = – 1158 кДж.
в) Розрахуємо стандартну енергію Гіббса утворення йонів Cu2+, враховуючи, що ΔG0(Al)=0 та ΔG0(Cu)=0:
ΔG0 = 2·ΔG0(Al3+) – 3·ΔG0(Cu2+);

Приклад 2. Складіть схему гальванічного елемента (ГЕ), в якому здійснюється струмоутворююча реакція, що відповідає рівнянню:
Cr + Au3+ = Cr3+ + Au
Напишіть рівняння електродних процесів. Розрахуйте: а) стандартну електрорушійну силу ГЕ, використовуючи зміну стандартної енергії Гіббса струмоутворюючої реакції, якщо відомі стандартні енергії Гіббса утворення йонів: ΔG0(Cr3+)= – 208 кДж/моль, ΔG0(Au3+)= 411 кДж/моль; б) концентрацію йонів Au3+, якщо коцентрація йонів Cr3+ становить 10-3 моль/л, а електрорушійна сила ГЕ дорівнює 2,071 В.
Розв’язання. Виходячи з рівняння наведеної в умові струмоутворюючої реакції, можна зробити висновок, що ГЕ утворений з двох металічних електродів, занурених у розчини своїх солей: один електрод – пластина хрому, а інший – пластина золота.
Оскільки φ0 Cr3+ | Cr < φ0 Au3+ | Au (Табл. Д.6), то анодом є пластина хрому, а катодом – пластина золота.
Складаємо схему ГЕ:
(Анод) Cr | Cr3+ || Au3+ | Au (Катод)
“–” “+”
Електрони рухаються у зовнішньому колі від анода, на якому відбувається окиснення атомів хрому, до катода, на якому відбувається відновлення йонів Au3+. Запишемо рівняння електродних процесів.
Рівняння анодного процесу:
Cr – 3e– = Cr3+ | 1
Рівняння катодного процесу:
Au3+ + 3e– = Au | 1
Складаємо рівняння електродних процесів і одержуємо рівняння струмоутворюючої реакції, яке збігається з наведеним в умові:
Cr + Au3+ = Cr3+ + Au
а) Розрахуємо зміну стандартної енергії Гіббса струмоутворюючої реакції, використовуючи стандартні енергії Гіббса утворення йонів Cr3+ та Au3+ і враховуючи, що ΔG0(Au)=0 та ΔG0(Cr)=0:
ΔG0 = ΔG0(Cr3+) – ΔG0(Au3+) =
= 1 моль·(–208 кДж/моль) – 1 моль·411 кДж/моль) = – 619 кДж
Стандартну електрорушійну силу ГЕ обчислимо за виразом (10.10), де n = 3 моль електронів, оскільки 1 моль атомів хрому віддає 3 моль електронів і цю кількість електронів приєднує 1 моль йонів Au3+.
ΔG0= – nFE0, 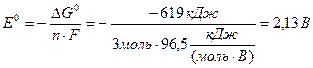
б) За рівнянням Нернста для металічних електродів (10.6) розрахуємо електродний потенціал пластини хрому:

Електродний потенціал пластини золота дорівнює:
Е = φкатода – φанода = φ Au3+ | Au – φ Cr3+ | Cr
φ Au3+ | Au = Е + φ Cr3+ | Cr =2,071+ (– 0,769) = 1,302 В
Виходячи з рівняння Нернста (10.6), обчислюємо концентрацію йонів Au3+ у розчині, в якому знаходиться пластина золота:
 ,
,
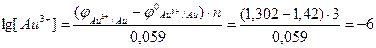
Отже, концентрація йонів Au3+ у розчині дорівнює: 
Приклад 3. Гальванічний елемент (ГЕ) складається зі срібної пластини, зануреної у розчин солі з концентрацією йонів Ag+ 10–5 моль/л, та водневого електрода з концентрацією йонів Н+ 0,01 моль/л. Наведіть схему ГЕ, запишіть рівняння електродних процесів та струмоутворюючої реакції. Розрахуйте електрорушійну силу ГЕ.
Розв’язання. Розрахуємо за рівняннями Нернста (10.6) та (10.7) потенціал срібного та водневого електродів:
 ,
,
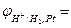 0,059lg[H+] = 0,059·lg10–2 = – 0,118 В
0,059lg[H+] = 0,059·lg10–2 = – 0,118 В
Оскільки  <
<  , то водневий електрод є анодом, а срібний – катодом.
, то водневий електрод є анодом, а срібний – катодом.
Схема ГЕ:
(Анод) Pt, H2 | H+ || Ag+ | Ag (Катод)
“–” “+”
На поверхні анода, тобто на поверхні платини, відбувається окиснення молекул водню.
Рівняння анодного процесу:
H2 – 2e- = 2H+ | 1
Електрони рухаються у зовнішньому колі від анода до катода. На поверхні катода, тобто срібного електрода, відбувається відновлення йонів арґентуму.
Рівняння катодного процесу:
Ag+ + e- = Ag | 2
Рівняння струмоутворюючої реакції одержуємо, складаючи рівняння електродних процесів, попередньо помноживши рівняння катодного процесу на 2.
H2 + 2Ag+ = 2H+ + 2Ag
Розрахуємо електрорушійну силу ГЕ:
Е = φ катода – φ анода = φ Ag+ | Ag – φ H+ | H2, Pt = 0,505 – (–0,118) = 0,623 В
Приклад 4. Складіть схему гальванічного елемента (ГЕ), в якому анодом є пластина кобальту у розчині солі з концентрацією йонів Со2+ 10–4 моль/л, а катодом – водневий електрод, занурений у розчин сульфатної кислоти. Електрорушійна сила ГЕ дорівнює 0,221 В.
Напишіть рівняння електродних процесів та струмоутворюючої реакції. Розрахуйте: а) потенціал металічного електрода; б) потенціал водневого електрода; в) рН розчину сульфатної кислоти та коцентрацію йонів Н+ у розчині.
Розв’язання. Складаємо схему ГЕ:
(Анод) Co | Co2+ || Н+ | H2, Pt (Катод)
“–” “+”
На аноді відбувається окиснення атомів кобальту. Електрони рухаються у зовнішньому колі до катода, на якому відбувається відновлення йонів гідрогену.
Рівняння анодного процесу:
Со – 2e- = Со | 1
Рівняння катодного процесу:
2H+ + 2e- = H2 | 1
Складаючи рівняння анодного та катодного процесів, одержуємо рівняння струмоутворюючої реакції:
Со + 2H+ = Со2+ + H2
Розрахуємо:
а) потенціал кобальтового електрода за рівнянням Нернста для металічних електродів (10.6):
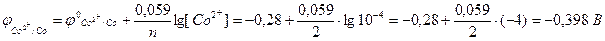
б) потенціал водневого електрода:
Е = φ катода – φ анода = φ H+ | H2, Pt – φ Со2+ | Со,
φ H+ | H2, Pt = Е + φ Со2+ | Со = 0,221 + (–0,398) = – 0,177 В
в) рН розчину сульфатної кислоти за рівнянням Нернста для водневого електрода (10.8):
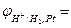 – 0,059рН
– 0,059рН

Враховуючи, що рН = –lg[H+], знаходимо концентрацію йонів гідрогену у розчині сульфатної кислоти (9.13):
[H+] = 10–рН=10-3 моль/л.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 4649; Нарушение авторских прав?; Мы поможем в написании вашей работы!