
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анодні процеси
На аноді, тобто електроді, який підключений до позитивного полюса джерела струму, відбувається процес окиснення. До анода рухаються аніони – негативно заряджені йони електроліту та орієнтуються навколо поверхні анода своїми негативними полюсами полярні молекули води.
На аноді можливі такі процеси:
- окиснення металу, з якого виготовлений анод:
Ме0 - nē = Men+. (13.4)
Цей процес відбувається за потенціалу, що дорівнює потенціалу металічного електрода φ0 Меn+/Ме (Табл. Д.6);
- окиснення аніонів кислотних залишків у розчинах солей металів та кислот;
- окиснення атомів оксигену, які містяться в молекулах води, в нейтральних та кислих розчинах солей металів, або атомів оксигену, що містяться в йонах ОН– у розчинах лугів та в їх розплавах:
2Н2О-2 - 4ē = О20 + 4Н+ (рН≤7) (13.5)
4OH– - 4ē = О20 + 2Н2О (рН>7) (13.6)
Потенціал цих процесів дорівнює потенціалу кисневого електрода і розраховується за рівнянням Нернста (10.9):
φ OH-/O2 = 1,23 – 0,059 рН
Продукти електролізу на аноді можна визначити, враховуючи, що на аноді відбувається той процес окиснення, потенціал якого менший. Нижче наведені правила визначення продуктів електролізу водних розчинів солей металів, кислот та лугів на аноді.
1. Якщо потенціал металічного електрода менший за потенціал кисневого електрода, то відбувається окиснення металу, з якого виготовлений анод, тобто його розчинення (13.4):
Ме0 - nē = Men+
Такі аноди мають назву розчинних анодів. Потенціал кисневого електрода в нейтральних та кислих розчинах солей та у розчинах кислот (рН≤7) знаходиться в межах таких значень:
φ OH-/O2 = 1,23 – 0,059 рН = 0,82 ÷ 1,23 В
Отже, розчинні аноди виготовляють з металів, розміщених в таблиці Д.6 від срібла та вище, тобто зі срібла, міді, кадмію, нікелю, свинцю, олова, хрому, цинку тощо, тобто з металів, потенціал яких менший, ніж +0,8 В, за винятком розчинних у воді лужних та лужно-земельних металів.
Потенціали окиснення аніонів кислотних залишків (PO43–, SO42–, NO3– тощо) значно вищі за потенціал кисневого електрода, тому при порівнянні потенціалів анодних процесів їх не враховують.
2. Аноди, виготовлені з металів з високим електродним потенціалом (золото, платинові метали), а також вугільні та графітові аноди належать до нерозчинних або інертних.
Які саме частинки окиснюються на нерозчинному аноді, можна визначити так.
а) під час електролізу водних розчинів оксигенвмісних кислот та їх солей окиснення аніонів (SO42-, CO32-, NO3-, PO43- та інших) не відбувається через високі потенціали їх окиснення. Замість цих йонів окиснюються атоми оксигену, що містяться у складі молекул води (13.5):
2Н2О-2 - 4ē = О20 + 4Н+
б) якщо електролізу піддаються водні розчини безоксигенових кислот та їх солей окиснюються аніони (Cl-, Br-, I-, S2-, окрім F-), а не атоми оксигену молекул води:
2Cl- - 2ē = Cl20
S2- - 2ē = S0
Окиснення йонів F- на аноді у водних розчинах неможливе через те, що потенціал цього процесу (+2,84 В) значно більший за потенціал кисневого електрода. Тому замість цих йонів окиснюються атоми оксигену молекул води.
в) під час електролізу водних розчинів та розплавів лугів відбувається окиснення йонів ОН– (13.6):
4ОН- - 4ē = О20 + 2Н2О
Висновок: На нерозчинному аноді окиснюються простіші за складом частинки.
Кількісні характеристики процесів електролізу визначаються об`єднаним законом Фарадея: Маси речовин, які окиснюються або відновлюються на електродах, а також маси утворених на електродах речовин прямо пропорційні кількості електрики, що проходить через розчин або розплав електроліту, та молярним масам еквівалентів цих речовин.
Математичним виразом закону є таке рівняння:
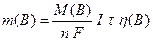 , (13.7)
, (13.7)
де m(B) – маса речовини, г,
М(В) – молярна маса речовини, г/моль,
n – число електронів в електродному процесі,
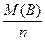 – молярна маса еквівалентів речовини, г/моль,
– молярна маса еквівалентів речовини, г/моль,
F – стала Фарадея (заряд 1 моль електронів):
F = 96500 Кл/моль (А·с/моль) або F = 26,8 А·год/моль,
 – молярна маса електрохімічних еквівалентів речовини, яка
– молярна маса електрохімічних еквівалентів речовини, яка
вимірюється г/Кл або г/(А·год),
I – сила струму, А,
τ – тривалість електролізу, с або год,
I · τ = Q - загальна кількість електрики, Кл (А·с) або А·год,
η(В) – вихід речовини за струмом.
Вихід речовини за струмом η(В) показує, яка частка від загальної кількості електрики Q витрачається, наприклад, на утворення певної речовини. Якщо на електроді відбувається тільки один процес, наприклад, утворюється тільки одна речовина, то вихід цієї речовини за струмом дорівнює 100% або 1. Якщо на електроді відбуваються одночасно декілька процесів, тобто, утворюються декілька речовин, сумарний вихід за струмом цих речовин дорівнює 100% (Ση і = 1).
Тоді I · τ · η(В) = Q(В) – це кількість електрики, що припадає на долю однієї з цих речовин.
Тому вираз (13.7) можна записати так:
 (13.8)
(13.8)
У випадку утворення газуватої речовини вираз об`єднаного закону Фарадея має такий вигляд:
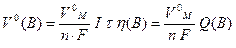 , (13.9)
, (13.9)
де V0(В) – об’єм газуватої речовини, що виділяється на електроді, л;
V0M – молярний об’єм газуватої речовини, який за н.у. дорівнює 22,4 л/моль.
З виразів (13.8) та (13.9) можна зробити такі висновки:
1) Внаслідок проходження через розчин або розплав електроліту кількості електрики, що дорівнює сталій Фарадея (Q(B)=96500 Кл або Q(B) = 26,8 А·год), маса речовини, яка утворюється на електроді, чисельно дорівнює молярній масі її еквівалентів:
Q(B) = F, 
А об`єм газуватої речовини за таких умов чисельно дорівнює молярному об`єму еквівалентів цієї речовини:
Q(B) = F, 
2) Якщо кількість електрики становить: Q(B)=1 Кл або Q(B) =1 А·год, то маса утвореної на електроді речовини чисельно дорівнює:
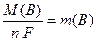 (13.10)
(13.10)
і називається молярною масою електрохімічних еквівалентів речовини.
Приклад 1. Складіть рівняння електродних процесів, які відбуваються на графітових електродах під час електролізу а) водного розчину натрій броміду, б) розплаву натрій броміду. Визначте масу речовин, що утворюються на електродах під час проходження крізь розчин та розплав електроліту кількості електрики 48250 Кл.
Розв’язання.
а) У розчині сіль натрій бромід дисоціює на йони: 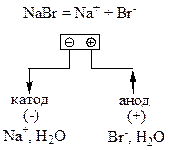
Ця сіль утворена сильною основою (NaOH) та сильною кислотою (HBr), тому гідролізу не піддається. Отже, розчин солі є нейтральним (рН=7).
До катода (негативного електрода) рухаються катіони – йони Na+, але потенціал їх відновлення (φ0 Na+/Na = -2,71 В) набагато менший за потенціал водневого електрода, який у нейтральному розчині дорівнює (10.8):
φ Н+/Н2 = - 0,059·рН = - 0,059·7 = -0,41 В
Тому на катоді відновлюються атоми гідрогену, що містяться у складі молекул води (13.2):
2Н+ОН + 2ē = Н20 + 2ОН–
До анода (позитивного електрода) рухаються аніони – йони Br–. Графітовий анод належить до нерозчинних анодів. Оскільки йони Br– є простішими за складом частинками, ніж молекули Н2О, то на нерозчинному аноді окиснюються йони Br–:
2Br– - 2ē = Br20.
б) Під час електролізу розплава NaBr, тобто у відсутності води, на катоді (негативному електроді) відбувається відновлення йонів Na+:
Na+ + ē = Na.
На аноді (позитивному електроді), як і під час електролізу розчину, окиснюються йони Br–:
2Br– - 2ē = Br20.
Розрахуємо за об’єднаним законом Фарадея (13.7) масу водню, натрію та брому, що утворюються на електродах. Враховуючи, що на кожному електроді утворюється тільки одна речовина, вихід речовини за струмом дорівнює 100% (η(H2)=1, η(Na)=1, η(Вr2)=1):
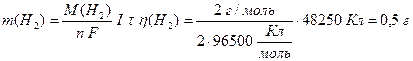 ,
,
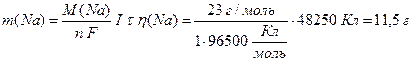 ,
,
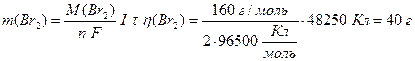 .
.
Приклад 2. Складіть рівняння електродних процесів, які відбуваються на срібних електродах під час електролізу водного розчину аргентум нітрату. Струм якої сили проходить крізь розчин, якщо маса анода за 1,5 години зменшилась на 12 г?
Розв’язання.
Сіль аргентум нітрат дисоціює у розчині на такі йони:
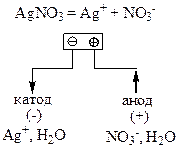
До катода (негативного електрода) рухаються катіони Ag+. Оскільки електродний потенціал срібного електрода (φ0 Ag+/Ag = +0,80 В) набагато більший, ніж потенціал водневого електрода (φ Н+/Н2 ≤ 0), то на катоді відбувається відновлення йонів Ag+ (14.1):
Ag+ + ē = Ag0
Срібний анод є розчинним, тобто відбувається окиснення срібла (13.4):
Ag0 - ē = Ag+
Отже, срібло, з якого виготовлений анод, розчиняється і його маса зменшується.
Розрахуємо за об’єднаним законом Фарадея (13.7) силу струму, враховуючи, що на аноді відбувається лише один процес – окиснення срібла, і тому η(Ag)=1:

Приклад 3. Складіть рівняння електродних процесів, які відбуваються на вугільних електродах під час електролізу водного розчину ферум (II) сульфату. Визначте масу металу, який утворюється на катоді за 30 хвилин, якщо сила струму 13,4 А, а вихід металу за струмом дорівнює 60%. Який газ та у якому об’ємі виділяється за таких умов на катоді, а який на аноді?
Розв’язання.
Сіль ферум (II) сульфат у розчині дисоціює на такі йони:
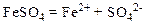
Внаслідок гідролізу цієї солі розчин стає кислим (рН<7):

Отже, у розчині солі йони Н+ знаходяться у надлишку.
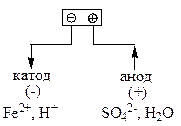
До катода (негативного електрода) рухаються катіони – йони Fe2+ та йони Н+. В ряду стандартних електродних потенціалів (Табл.Д.6) залізо знаходиться між алюмінієм та водневим електродом, тобто:
φ0 Al3+/Al < φ0 Fе2+/Fе < φ0 Н+/Н2
В цьому випадку на катоді утворюється шар металу і одночасно виділяється водень:
Fe2+ + 2ē = Fe0
2Н+ + 2ē = Н20
Вугільний анод належить до нерозчинних анодів. До анода (позитивного електрода) рухаються аніони SO42-, але окиснюються молекули води, які є простішими за складом частинками, ніж аніони SO42- (13.5):
2Н2О-2 - 4ē = О20 + 4Н+
Оскільки на катоді відбуваються два процеси, тобто утворюються одночасно і залізо, і водень, то їх вихід за струмом дорівнює відповідно 60% та 40% (η(Fe)=0,6; η(H2)=0,4).
На аноді утворюється лише одна речовина – кисень, тому його вихід за струмом становить 100% (η(O2)=1).
Розрахуємо за об’єднаним законом Фарадея (13.7) та (13.9) масу заліза, об’єм водню та кисню за н.у.:
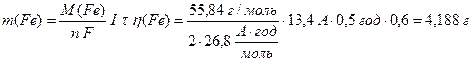

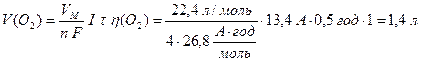
Приклад 4. Під час проходження через розчин солі двохвалентного металу МеCl2 електричного струму силою 5 А на катоді за 15 хвилин утворився тільки шар металу масою 4,55 г. Розрахуйте молярну масу металу та назвіть його. Визначте молярну масу електрохімічних еквівалентів металу.
Розв’язання.
Сіль МеCl2 дисоціює у розчині на такі йони:

За умовою на катоді утворюється тільки шар металу, тобто його вихід за струмом дорівнює 100% (η(Ме)=1) (13.1):
Ме2+ + 2ē = Ме0
За об`єднаним законом Фарадея (13.7) розрахуємо молярну масу металу:
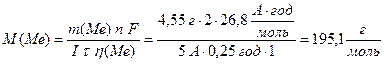 ,
,
де тривалість електролізу складає 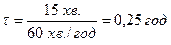 .
.
За періодичною системою елементів Д.І.Менделєєва визначаємо, що цей метал – платина Pt.
Молярна маса електрохімічних еквівалентів платини дорівнює (13.10):
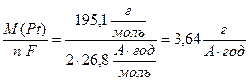 .
.
|
|
Дата добавления: 2015-05-23; Просмотров: 1532; Нарушение авторских прав?; Мы поможем в написании вашей работы!