
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
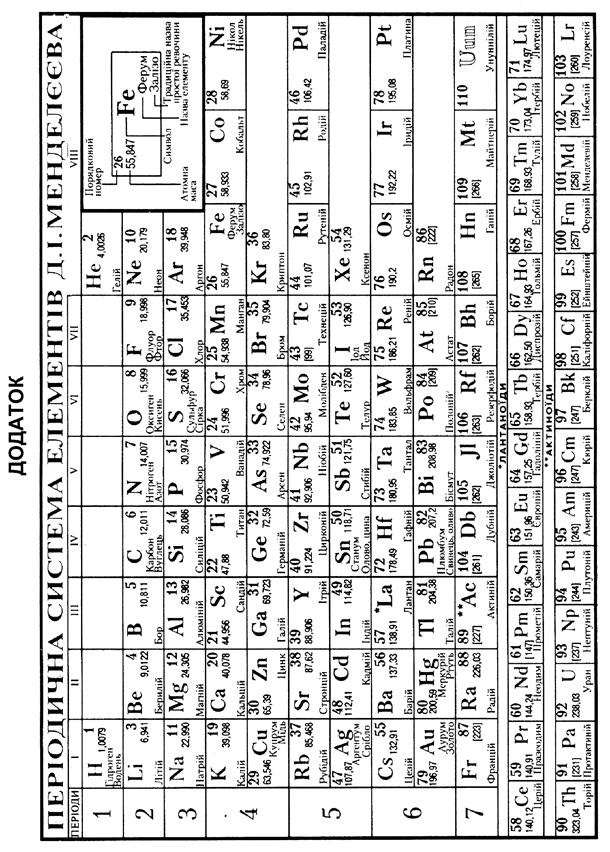
ДОДАТОК. Таблица Д.1. Відносна електронегативність елементів
|
|
|
|
Таблица Д.1. Відносна електронегативність елементів.
| H 2,1 | ||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,2 | S 2,5 | Cl 3,0 |
| K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 |
| Cs 0,7 | Ba 0,9 | TI 1,8 | Pb 1,8 | Bi 1,9 | Po 2,0 | At 2,2 |
| Fr 0,7 | Ra 0,9 |
Таблиця Д.2. Стандартні ентальпії утворення DН°298 деяких речовин
| Речовина | D Н°298, кДж/моль | Речовина | D Н°298, кДж/моль |
| СО2 (Г) | -393,5 | FeO (Т) | –265 |
| CO (К) | -110,5 | Fe2O3 (Т) | -822,2 |
| Ca3(PO4)2 (Т) | -4137,5 | P2O5 (Т) | –1492 |
| Al2O3 (Т) | –1676 | NH3 (Г) | –46 |
Таблиця Д.3. Стандартні енергії Гіббса утворення DG°298 деяких речовин
| Речовина | D G°298, кДж/моль | Речовина | D G°298, кДж/моль |
| Al2O3 (T) | –1582 | NH3 (Г) | -17 |
| Fe3O4 (T) | –1014 | CH4 (Г) | -51 |
Таблиця Д.4. Стандартні ентропії S°298 деяких речовин
| Речовина | S°298, Дж/(K·моль) | Речовина | S°298, Дж/(K·моль) |
| О2 (Г) | Ti (Т) | 30,6 | |
| Fe (T) | TiO2 (Т) | 50,3 | |
| Al (T) | C (Графіт) | 5,7 | |
| Al2O3 (T) | CO (Г) | 197,5 |
Таблиця Д.5. Розчинність кислот, основ та солей у воді (р - розчиняється, н - не
розчиняється, м - мало розчиняється, “-“ (риска) - не існує або розкладається водою)
| Іони | OH- | NO3- | Cl- | Br- | I- | S2- | SO32- | SO42- | CO32- | SiO32- | PO43- | CH3COO- |
| H+ | p | p | p | p | p | p | p | p | р | н | р | р |
| NH4+ | р | р | р | р | р | р | р | р | р | р | р | р |
| K+ | Р | р | р | р | р | р | р | р | р | р | р | р |
| Na+ | р | р | р | р | р | р | р | р | р | р | р | р |
| Ag+ | - | р | н | н | н | н | н | н | н | - | н | р |
| Ba2+ | р | р | р | р | р | - | н | н | н | н | н | р |
| Ca2+ | р | р | р | р | р | - | н | м | н | н | н | р |
| Mg2+ | н | р | р | р | р | - | н | р | н | н | н | р |
| Zn2+ | н | р | р | р | р | н | н | р | н | н | н | р |
| Cu2+ | н | р | р | р | - | н | - | р | - | н | н | р |
| Hg2+ | - | р | р | м | н | н | - | р | - | - | н | р |
| Pb2+ | н | р | м | м | н | н | н | н | н | н | н | р |
| Sn2+ | н | р | р | р | м | н | - | р | - | - | н | р |
| Ni2+ | н | р | р | р | р | н | н | р | н | - | н | р |
| Cd2+ | н | р | р | р | р | н | н | р | н | - | н | р |
| Co2+ | н | р | р | р | р | н | н | р | н | - | н | р |
| Fe2+ | н | р | р | р | р | н | н | р | н | н | н | р |
| Fe3+ | н | р | р | р | - | - | - | р | - | н | н | р |
| Al3+ | н | р | р | р | р | - | - | р | - | н | Н | р |
| Cr3+ | н | р | р | р | р | - | - | р | - | - | Н | р |
Таблиця Д.6. Стандартні потенціали металічних електродів
| Метал | Електродна реакція | jо, В | Метал | Електродна реакція | jо, В |
  Li Li
| Li++e Li | -3,05 | Cd | Cd2++2e Cd | -0,40 |
| K | K++e K | -2,92 | Co | Co2++2e Co | -0,28 |
| Ba | Ba2++2e Ba | -2,91 | Ni | Ni2++2e Ni | -0,25 |
| Ca | Ca2++2e Ca | -2,87 | Sn | Sn2++2e Sn | -0,14 |
| Na | Na++e Na | -2,71 | Pb | Pb2++2e Pb | -0,13 |
| Mg | Mg2++2e Mg | -2,27 | Fe | Fe3++3e Fe | -0,04 |
| Be | Be2++2e Be | -1,85 | H2 | 2H++2e H2 | 0,0 |
| Al | Al3++3e Al | -1,66 | Cu | Cu2++2e Cu | +0,34 |
| Ti | Ti2++2e Ti | -1,63 | Ag | Ag++e Ag | +0,80 |
| Mn | Mn2++2e Mn | -1,18 | Hg | Hg2++2e Hg | +0,85 |
| Zn | Zn2++2e Zn | -0,76 | Pt | Pt2++2e Pt | +1,19 |
| Cr | Cr3++3e Cr | -0,71 | Au | Au3++3e Au | +1,42 |
| Fe | Fe2++2e Fe | -0,44 |
Таблиця Д.7. Стандартні електродні потенціали деяких окисно-відновних (редокс-) електродів
| Електродна реакція | jо, В |
Окиснена форма + n е-  відновлена форма відновлена форма
| |
MnO4-+ 8H+ + 5e  Mn2+ + 4H2O Mn2+ + 4H2O
| +1,51 |
MnO4- + 2H2O + 3e  MnO2 + 4OH- MnO2 + 4OH-
| +0,60 |
MnO4- + e  MnO42- MnO42-
| +0,56 |
MnO2 + 4H + + 2e  Mn2+ + 2H2O Mn2+ + 2H2O
| +1,23 |
Cr2O72- + 14H+ + 6e  2Cr3+ + 7H2O 2Cr3+ + 7H2O
| +1,33 |
HNO2 + H+ + e  NO + H2O NO + H2O
| +0,99 |
NO3- + 2H+ + e  NO2 + H2O NO2 + H2O
| +0,78 |
NO3- + 4H+ + 3e  NO + 2H2O NO + 2H2O
| +0,96 |
2NO3- + 12H ++ 10 e  N2 + 6H2O N2 + 6H2O
| +1,24 |
NO3 - + 3H+ + 2e  HNO2 + H2O HNO2 + H2O
| +0,94 |
S + 2H+ + 2e  H2S H2S
| + 0,14 |
SO42- + 4H+ + 2e  SO2 + 2H2O SO2 + 2H2O
| +0,17 |
SO42- + 8 H+ + 6e  S + 4H2O S + 4H2O
| +0,36 |
SO42- + 10H+ + 8e  H2S + 4H2O H2S + 4H2O
| +0,31 |
H2SO3 + 4 H+ + 4e  S + 3H2O S + 3H2O
| +0,45 |
F2 + 2e  2F- 2F-
| +2,84 |
Cl2 + 2e  2Cl- 2Cl-
| +1,36 |
Br2 + 2e  2Br- 2Br-
| +1,08 |
I2 + 2e  2I- 2I-
| +0,53 |
Co3+ + e  Co2+ Co2+
| +1,84 |
Fe3+ + e  Fe2+ Fe2+
| +0,77 |
Sn4+ + 2e  Sn2+ Sn2+
| +0,15 |
2Hg2+ + 2e  Hg22+ Hg22+
| +0,92 |
PbO2 + 4H+ + 2e  Pb2+ + 2H2O Pb2+ + 2H2O
| +1,45 |
O2 + 2H2O + 4e  4OH- 4OH-
| +0,40 |
O2 + 4 H+ + 2e  2H2O 2H2O
| +1,23 |
O2 + 2 H+ + 2e  H2O2 H2O2
| +0,68 |
H2O2 + 2 H+ + 2e  2H2O 2H2O
| +1,78 |
СПИСОК ЛІТЕРАТУРИ
1. Степаненко О.М., Рейтер Л.Г., Ледовських В.М., Іванов С.В. Загальна та неорганічна хімія. Частина 1. – К.: Педагогічна преса, 2002.– 520 с., ISBN 966-7320-13-8.
2. Романова Н.В. Загальна та неорганічна хімія. – К:Перун, 1998.– 480 с., ISBN 966-569-106-6.
3. Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. – М.:Высш. шк., 2001.–743 с., ISBN 5-06-003363-5.
4. Коровин Н. В. Общая химия: Учеб. для те хнич. направл. и спец. вузов – М.: Высш. шк., 2000. – 558 с., ISBN 5-06-003939-0.
5. Григор`єва В.В., Самійленко В.М., Сич А.М. Загальна хімія: Підручник – К.: Вища шк., 1991. – 431 с., ISBN 5-11-003667-5.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 799; Нарушение авторских прав?; Мы поможем в написании вашей работы!