
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості оксидів
|
|
|
|
Оксиди беруть участь в реакціях кислотно-основної взаємодії, внаслідок яких утворюються солі. Сіль складається з залишків основи та кислотних залишків. В наведених нижче рівняннях реакцій залишки основи позначені рискою, а кислотні залишки – фігурною дужкою.
Основні оксиди реагують з речовинами кислотного характеру з утворенням солей:
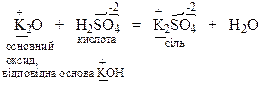
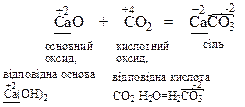
Кислотні оксиди взаємодіють з речовинами основного характеру з утворенням солей:
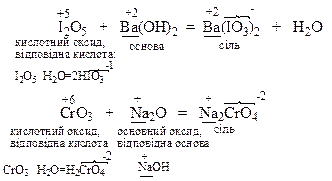
Амфотерні оксиди реагують з речовинами кислотного характеру як основні оксиди, а з речовинами основного характеру як кислотні оксиди з утворенням солей:
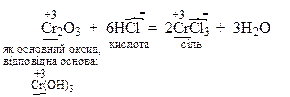
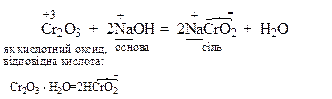
Гідроксиди - це продукти приєднання води до оксидів. Гідроксид зберігає хімічний характер відповідного оксиду. Тому гідроксиди поділяють на основи, амфотерні гідроксиди та кислоти.
Основи - це гідроксиди основних оксидів, тобто гідроксиди металів з валентністю І та II. Основи поділяють на розчинні у воді та малорозчинні. Розчинні у воді основи утворені лужними та лужно-земельними металами і називаються лугами. Це LiОН, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Ва(OH)2 та Sr(ОН)2. Основи, що утворені іншими металами, малорозчинні у воді.
Добування основ: а) луги добувають розчиненням у воді лужних та лужно-земельних металів або розчиненням у воді їх оксидів:
2Nа + 2H2O = 2NaOH + H2
CaO + H2O = Ca(OH)2,
б) малорозчинні у воді основи добувають за реакцією обміну між розчином солі та розчином лугу:
CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4
Хімічні властивості основ. Основи реагують з речовинами кислотного характеру з утворенням солей:
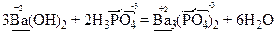
Амфотерні гідроксиди - це гідроксиди амфотерних оксидів, тобто гідроксиди металів з валентністю III, ІV та деяких металів з валентністю II: Аl(OH) 3, Cr(OH) 3, Mn(OH) 4, Sn(OH) 2, Zn(OH) 2, Pb(OH) 2, Ве(ОН)2 тощо.
Добування амфотерних гідроксидів. Амфотерні гідроксиди є малорозчинними у воді, тому їх добувають за реакцією обміну між розчином солі та розчином лугу:
AlCl3 + 3KOH = Al(OH)3¯ + 3KCl
Хімічні властивості амфотерних гідроксидів. Амфотерні гідроксиди реагують з речовинами кислотного характеру як основи, а з речовинами основного характеру як кислоти з утворенням солей:
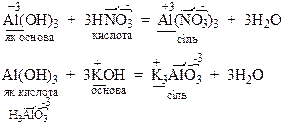
Амфотерність гідроксидів можна розглядати, як утворення в розчинах гідроксокомплексних сполук:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] – натрію тетрагідроксоцинкат (ІІ)
Al(OH)3 + 3NaOH = Na3[Al(OH)6] – натрію гексагідроксоалюмінат (ІІІ)
Атом металу, оточений йонами ОН–, число яких дорівнює у більшості подвоєній валентності металу, складає внутрішню сферу сполуки (комплексний аніон). Заряд цього аніону компенсується йонами K+ або Na+, які знаходяться у зовнішній сфері сполуки.
Назва основ і амфотерних гідроксидів складається аналогічно назвам оксидів: з назви металу (у разі необхідності зазначають його валентність) і слова „гідроксид” (це назва груп ОН): NaOH – натрій гідроксид, Ca(OH)2 – кальцій гідроксид, Cr(OH)3 – хром (ΙΙΙ) гідроксид.
Кислоти - це сполуки, що містять атоми гідрогену, які здатні заміщуватись на атоми металу. Кислоти поділяють на безоксигенові та оксигенвмісні. До безоксигенових кислот належать водні розчини деяких сполук гідрогену з атомами неметалів, а саме: HF, НСl, HBr, HI, Н2S, Н2Sе, НСN тощо. Оксигенвмісні кислоти - це гідроксиди кислотних оксидів. Їх утворюють метали з валентністю V, VІ, VІІ та неметали незалежно від іх валентності.
Основність кислоти визначається числом атомів гідрогену у складі молекули кислоти, здатних заміщуватись на атоми металу. Наприклад, одноосновними кислотами є НСl, HNO3, СН3СООН, двохосновними – Н2S, Н2СO3, H2SO4, трьохосновними – H3PO4, H3AsO4 , чотирьохосновними – H4SiO4, H4P2O7.
Назви кислот: Назви деяких безоксигенових кислот: HF – фторидна, HCl – хлоридна, HBr – бромідна, HI – йодидна, HCN – ціанідна, H2S – сульфідна. Назва оксигенвмісної кислоти, в якій елемент виявляє вищий ступінь окиснення, має суфікс „-ат”, а зі зниженням ступеня окиснення – „-іт” або „-ит”: HNO3 – нітратна, HNO2 – нітритна, H2SO4 – сульфатна, H2SO3 – сульфітна, H2CO3 – карбонатна. Якщо одному і тому ж кислотному оксиду відповідають декілька кислот, в яких містяться по одному атому елемента в молекулі, то до назви кислоти з меншим вмістом атомів оксигену додають префікс “мета-”, а з найбільшим – префікс “орто-”. Наприклад, HPO3 – метафосфатна, а H3PO4 – ортофосфатна кислоти.
Добування кислот:
а) розчинення у воді деяких кислотних оксидів:
SO2 + H2O = H2SO3,
б) реакція обміну між сіллю кислоти, яку треба одержати, та більш сильною кислотою:
Na2SiO3 + 2HNO3 = H2SiO3↓+ 2NaNO3
FeS + 2HCl = H2S↑+ FeCl2
Xімічні властивості кислот. Кислоти реагують з речовинами основного характеру з утворенням солей:
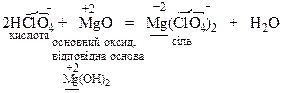
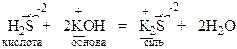
Солі розглядають як продукти заміщення атомів гідрогену кислоти на залишки основи, або як продукти заміщення груп ОН у складі основи на кислотні залишки. Розрізняють середні, кислі та основні соли.
Середні солі - це продукти повного заміщення атомів гідрогену кислоти на атоми металу. Середня сіль складається з йонів металу та кислотних залишків, які не містять атомів гідрогену, тому і назва середньої солі складається з назви металу та назви аніону кислотного залишку.
| Кислоти | Кислотний залишок | Залишок основи | Середня сіль | Назва солей |
| H3PO4 | 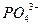
| Na+ | Nа3PO4 | Натрій ортофосфат |
| H2CO3 | 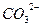
| Ca2+ | CaCO3 | Кальцій карбонат |
| H2SO4 | SO42- | Fe3+ | Fe2(SO4)3 | Ферум (ІІІ) сульфат |
Добування середніх солей:
а) реакції кислотно-основної взаємодії, тобто реакції між речовинами кислотного та основного характеру:
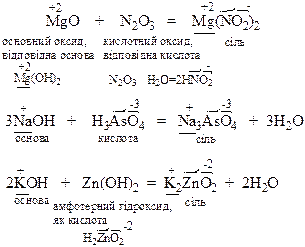
б) малорозчинні у воді солі можна одержати за реакцією обміну:
– між розчинами солей: Na2CO3 + CaCl2 = CaCO3¯ + 2NaCl,
– між розчинами солі та кислоти: AgNO3 + HCl = AgCl¯ + HNO3,
– між розчинами солі та основи: K2SO4 + Ba(OH)2 = BaSO4¯ +2KOH.
Кислі солі - це продукти неповного заміщення атомів гідрогену багатоосновних кислот на атоми металу. Кисла сіль складається з йонів металу та кислотних залишків, що містять атоми гідрогену.
| Кислота | Кислотні залишки | Залишок основи | Кислі солі | Назва солей |
| H3PO4 | 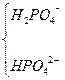
| Na+ | NaH2PO4 | Натрій дигідрогенортофосфат |
| Na+ | Na2HPO4 | Натрій гідрогенортофосфат | ||
| H2CO3 | 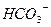
| Ca2+ | Ca(HCO3)2 | Кальцій гідрогенкарбонат |
В назвах кислих солей використовується префікс "гідроген" та вказується число атомів гідрогену у складі кислотного залишку.
Добування кислих солей. Кислі солі можна одержати:
а) внаслідок взаємодії середньої солі з однойменною кислотою:
 CaCO3 + CO2 + H2O =Ca(HCO3)2 ,
CaCO3 + CO2 + H2O =Ca(HCO3)2 ,
H2CO3
2Na3PO4 + Н3PO4= 3Na2HPO4 ,
Na3PO4 + 2Н3PO4= 3NaH2PO4
б) внаслідок взаємодії кислоти з нестачею основи:
Н3PO4 + NaOН = NaH2PO4 + H2O,
Н3PO4 + 2NaOН = Na2HPO4 + 2H2O,
Властивості кислих солей:
а) більшість кислих солей розчинні у воді,
б) кислі солі розкладаються за нагрівання:
Ca(HCO3)2 = CaCO3¯ + CO2 + H2O,
в) кислі солі, як і кислоти, взаємодіють з речовинами основного характеру з утворенням середніх солей:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O,
Ca(HCO3)2 + 2NaOH = CaCO3¯ + Na2CO3 + 2H2O,
3NaH2PO4 + 6KOН = Na3PO4 + 2K3PO4 + 6H2O
г) кислі солі, як і середні, беруть участь в реакціях обміну з іншими солями та кислотами:
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4) 2¯ + 6NaHCO3,
Ca(HCO3)2 + Na2CO3 = CaCO3¯ + 2NaHCO3,
Ca(HCO3)2 + 2HCl = CaCl2 + CO2 + H2O,
Na2HPO4 + H2SO4 = H3PO4 + Na2SO4,
NaH2PO4 + HNO3 = H3PO4 + NaNO3
Основні солі. Основні солі є продуктами неповного заміщення груп ОН у складі основи кислотними залишками. Основна сіль складається з залишків основи, які містять групи ОН, та кислотних залишків, до складу яких не входять атоми гідрогену. Основні солі утворюють тільки ті основи, що містять декілька груп ОН.
Назви основних солей утворюють з назв металу, аніонів кислот і префіксу “гідроксо” та вказують число груп ОН.
| Основа | Залишки основи | Кислотний залишок | Основні солі | Назва солей |
| Co(OH)2 | CoOH+ | NO3– | CoOHNO3 | Гідроксокобальт (ІІ) нітрат |
| SO42– | (CoOH)2SO4 | Гідроксокобальт (ІІ) сульфат | ||
| Al(OH)3 | 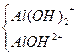
| Cl– | Al(OH)2Cl | Дигідроксоалюміній хлорид |
| Cl– | AlOHCl2 | Гідроксоалюміній хлорид |
Добування основних солей. Основні солі утворюються:
а) під час взаємодії основи з нестачею кислоти:
Cо(ОН)2 + HNO3 = CоOHNO3 + H2O,
2Cо(ОН)2 + H2SO4 = (CoOH)2SO4 + 2H2O,
Al(OH)3 + HCl = Al(OH)2Cl + H2O,
Al(OH)3 + 2HCl = AlOHCl2 + 2H2O
б) під час взаємодії середньої солі з нестачею лугу:
Cо(NO3)2 + NaOH = CoOHNO3 + NaNO3,
AlCl3 + NaOH = AlOHCl2 + NaCl,
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl
Властивості основних солей:
а) основні солі є малорозчинними у воді;
б) основні солі, як і основи, взаємодіють з речовинами кислотного характеру з утворенням середніх солей:
CоOHNO3 + HNO3 = Cо(NO3)2 + H2O,
(CoOH)2SO4 + 2HNO3 = Cо(NO3)2 + CoSO4 + 2H2O,
3AlOHCl2 + 3HNO3 = 2AlCl3 + Al(NO3)3 + 3H2O
в) основні солі реагують з лугами. Внаслідок витіснення кислотних залишків з молекули основної солі групами ОН утворюється метал гідроксид:
СоOHNO3 + NaOH = Cо(OH)2¯ +NaNO3,
Al(OH)2Cl + KOH = Al(OH)3 + KCl,
AlOHCl2 + 2KOH = Al(OH)3 + 2KCl.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1646; Нарушение авторских прав?; Мы поможем в написании вашей работы!