
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Застосування сполук d – елементів у медицині
|
|
|
|
План
Тема: Біогенні d – елементи, їх біологічна роль та застосування в медицині
Позааудиторна самостійна робота № 2
Методичні рекомендації
1. При опрацюванні теоретичного матеріалу, що висвітлює перше питання, звернути увагу на біологічну роль р - елементів.
2.Після розгляду другого питання заповнити таблицю:
| Елемент | Препарат | Лікувальна дія |
3. Розглядаючи третє питання, скласти опорний конспект.
Запитання для самоконтролю:
1. Які сполуки Оксигену і Гідрогену використовують в медицині?
2. Вказати біологічну роль Сульфуру та медичні препарати, що вміщують цей елемент.
3.Які препарати Нітрогену застосовують в медичній практиці і для чого?
4.Охарактеризувати терапевтичну дію лікарських препаратів, що містять Фосфор.
Тести для самоконтролю:
І рівень
1. Вказати формулу „веселильного газу”:
а)NO; б) N2O; в) N2O3; г) NO2.
2. Масова частка гідроген пероксиду в пергідролі становить:
а) 10%; б) 20%; в) 15%; г)30%.
3. Вказати препарати – коронаролітики:
а)сульфазин; б) гідроперит; в) нітрогліцерин; г) сустак.
4. Який з р – елементів викликає хронічне захворювання сатурнізм:
а) Сульфур; б) Селен; в) Арсен; г) Плюмбум.
5.Якого газу найбільше в атмосферному повітрі:
а) азоту; б) кисню; в) чадного; г) гелію.
6. Вказати основну біологічну функцію Селену та його сполук:
а) антисептичний засіб; б) антидот при отруєнні хлором;
в) антиоксидант; г) протигельмінтний засіб.
ІІ рівень
7. Молярна маса гідропериту дорівнює:
а) 94 г/моль; б) 82 г/моль; в) 98 г/моль; г) 102 г/моль.
8. В результаті якої з реакцій утвориться цинк фосфат?
а) ZnO + H3PO4 =
б) Zn(OH)2 + K3PO4 =
в) Zn + Ca3(PO4)2 =
ІІІ рівень
9.У людини з вагою 60 кг маса внутрішньоклітинної рідини становить:
а) 36 кг; б) 40 кг; в) 42 кг; г) 24 кг.
1. Біологічна роль Феруму в організмі.
2. Роль Купруму і Цинку та їх біосполук у життєдіяльності організму.
3. Біологічна роль Мангану і Кобальту.
4.Важлива роль Молібдену, Хрому та Ніколу у функціонуванні біосистем.
5. Біологічна роль інших важливих біоелементів з родини d – елементів.
6. Застосування сполук d – елементів у медицині.
Час виконання: 2 години.
Мета роботи: розглянути біологічну роль біметалів з родини d – елементів та застосування їх сполук у медицині.
З великої групи d – елементів до біогенних відносять вісім найважливіших елементів, концентрація яких в організмі достовірно встановлена і їх специфічна фізіологічна роль доведена. Ці елементи входять до складу великої кількості металоферментів, яких нині відомо близько 300, а також деяких вітамінів. Високу каталітичну активність виявляють d – елементи і в складі різних біокомплексів. Так, біологічні функції мікроелементів у живих системахтісно пов’язані з процесами комплексоутворення між ними і біолігандами – білками, вітамінами тощо.
Ферум. Йони Феруму (ІІ) і (ІІІ) мають важливе значення для життєдіяльності організму людини. Вони необхідні для процесів кровотворення, нормальної діяльності деяких ферментів, перенесення кисню від легень до тканин, а також електронів у ланцюзі дихання.
Загальний вміст Феруму в організмі становить близько 5 г; багато його в печінці (500 – 600 мг), м’язах (400 – 450 мг), кістковому мозку (250 – 300 мг), проте 60 – 70% від його загальної маси міститься в еритроцитах та нервових клітинах. Ферум, що входить до складу біологічних систем, поділяють на гемовий і негемовий. Ферум у вигляді Fe2+, що входить до складу гемоглобіну, метгемоглобіну, цитохромів, називають гемовим, а в складі всіх інших біологічно активних сполук – феритину, гемосидерину, лактоферину, ферумсульфуровмісних білків тощо – називають негемовим.
Серед білків, що містять йони Феруму (ІІ) в гемах, найбільше значення мають гемоглобін і метгемоглобін. Гемоглобін (Hb), як дуже важливий компонент еритроцитів крові, забезпечує зв’язування і перенесення кисню від легень до всіх органів, а міоглобін – збереження запасів кисню в м’язах.
В одному літрі крові людини міститься в середньому 4,5∙1012 еритроцитів і в кожному з них є близько 400 млн молекул гемоглобіну. Тому 1 л крові за температури 200 С і нормального тиску вбирає 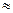 200 см3 кисню, а вода за таких самих умов – всього 6,6 см3. В організмі людини масою 70 кг міститься в середньому 5,0 – 5,5 л крові, отже з наведених даних видно, який великий об’єм кисню може переносити оксигемоглобін крові.
200 см3 кисню, а вода за таких самих умов – всього 6,6 см3. В організмі людини масою 70 кг міститься в середньому 5,0 – 5,5 л крові, отже з наведених даних видно, який великий об’єм кисню може переносити оксигемоглобін крові.
Ферум входить до складу інших біологічно активних сполук, зокрема цитохромів, які є носіями електронів у ланцюгу дихання. Функції цитохромів і гемоглобіну суттєво відрізняються, оскільки фізіологічна дія цитохромів побудована на принципі зміни ступеня окиснення Феруму:
Fe2+ - e 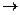 Fe3+
Fe3+
Fe3+ + e 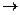 Fe2+
Fe2+
Необхідно зазначити, що еритроцити крові через певний час (80 – 120 днів) руйнуються і замінюються новими, але після їх розкладання Ферум не виводиться з організму, а сполучається з іншими білками, утворюючи біокомплекс – феритин, який регенерується кровотворними органами і знову перетворюється на гемоглобін.
Йони Феруму (ІІІ) входять до складу і таких важливих ферментів як каталаза і пероксидаза. Каталаза захищає клітини від токсичної дії гідроген пероксиду, а пероксидаза каталізує процеси окиснення різних органічних субстратів гідроген пероксидом.
Ферум має велике значення для організму людини, добова потреба в ньому становить 20 – 30 мг. Цей біоелемент у достатній кількості міститься в різноманітних продуктах харчування.
Вміст Феруму в продуктах харчування (у мг/кг маси)
| Назва продукту | Вміст | Назва продукту | Вміст |
| Легені | Хліб пшеничний | ||
| Печінка | Шпинат | ||
| Крупа вівсяна | Яйця | ||
| Крупа рисова | Крупа гречана |
Найчастіше дефіцит Феруму в організмі виникає не внаслідок недостатнього надходження його з продуктами харчування, а як результат порушення функції всмоктування та засвоєння його організмом. При нестачі в організмі сполук Феруму розвиваються різні хвороби крові, так звані залізодефіцитні анемії, внаслідок яких зменшується загальна кількість еритроцитів та вміст в них гемоглобіну. У надмірних дозах Ферум викликає дезактивацію ферментів циклу Кребса, що призводить до нагромадження органічних кислот в крові, а при хронічній інтоксикації – сидероз.
Купрум. Відомо більше 30 різних білків і ферментів, у складі яких виявлено йони Купруму (І) або (ІІ), які, подібно до Феруму, виконують функцію перенесення кисню та електронів в окисно – відновних процесах. Так, у крові безхребетних міститься спеціальний білок – гемоціанін, який за біологічною функцією є аналогом гемоглобіну, проте в ньому йони Феруму (ІІ) заміщені на йони Купруму (ІІ). Цей елемент входить і до складу деяких ферментів із групи оксидаз, що каналізують в організмі перебіг окремих ОВР. Наприклад, у сироватці крові виявлено білок церулоплазмін (з вмістом до 0,3% Cu), що каталізує процес окиснення йонів Fe2+ до Fe3+ та сприяє перенесенню електронів.
Отже, йони Купруму беруть участь у процесах дихання тканин, росту та кровотворення, сприяють синтезу гемоглобіну в організмі. Вони посилюють дію інсуліну та гормонів гіпофізу, впливаючи на обмін цукрів та жирів. Крім того, йони Купруму регулюють водно – електролітний обмін, оскільки сприяють виведенню з організму води, затримують Кальцій та фосфати, але не впливають на виведення хлоридів.
Дефіцит цього біоелемента може викликати анемію, патологічний ріст кісток, дефекти сполучної тканини, захворювання шкіри.
У незначних кількостях Купрум міститься у клітинах майже всіх органів людини, проте переважно концентрується в печінці та головному мозку. Рівень цього мікроелемента змінюється при інфекційних захворюваннях мозку (зокрема енцефаліті) та внаслідок деяких інших порушень функцій головного мозку, зокрема шизофренії та епілепсії. Сполуки Купруму використовують для зниження збудження ЦНС при психічних захворюваннях.
Загальна потреба дорослої людини в цьому біоелементі становить 2 -3 мг на добу. Вміст Купруму поповнюється за рахунок харчових продуктів, особливо круп, гороху, хліба, грибів, м’яса та ін.
При надлишку Купруму в організмі він нагромаджується в тканинах і викликає токсикоз (хворобу Вільямса). У тварин спостерігають переродження клітин печінки, виникнення цирозів та панкреатитів.
Цинк – один з найпоширеніших мікроелементів організму, оскільки займає друге місце після Феруму. Вміст його в організмі становить 1,5 – 2.3 г. Нині відомо понад 200 різноманітних металоферментів, які містять в структурі активних центрів цей хімічний елемент і беруть участь у метаболічних процесах – синтезу і розпаду вуглеводів, жирів, білків та нуклеїнових кислот.
Найкраще вивченим ферментом, що вміщує Цинк, є карбоксипептидаза, що каталізує реакцію розкладання білків до амінокислот Слід зазначити, що одні ферменти Цинк активує, а інші – інгібує. Біологічна роль цього елемента пов’язана з залозами внутрішньої секреції, в яких він і концентрується. Вважають, що простата добре функціонує за достатньої кількості Цинку в організмі.
Цинк відіграє важливу роль у функціонуванні клітин головного мозку, тому його й використовують для лікування психічних захворювань. Оскільки він сприяє загоєнню ран, то цинкові мазі здавна застосовують у дерматології.
Механізм впливу Цинку на цукрознижуючу дію інсуліну остаточно ще не з’ясований. Здатність Цинку підвищувати загальний енергетичний рівень біохімічних процесів та посилювати захисні реакції організму відкриває нові перспективи застосування його як стимулятора багатьох фізіологічних процесів. Проте, деякі дослідження вказують на взаємозв’язок між підвищеним рівнем Цинку в організмі та ймовірністю виникнення злоякісних пухлин. Хронічне отруєння сполуками Цинку призводить до гіпертонії, атеросклерозу, захворювання судин.
Манган – важливий мікроелемент для життєдіяльності організму. Він впливає на ріст людини, необхідний для утворення кісток, збереження репродуктивної функції організму, метаболізму глюкози та ліпідів. Особливо цей мікроелемент необхідний для активування ферментів, які каналізують складні процеси клітинного дихання, посилюють обмін вуглеводів та жирів, сприяють синтезу вітаміну С та обміну вітамінів групи В та Е. В організмі цей елемент перебуває у вигляді катіонів Mn2+, Mn3+.
В організмі людини міститься приблизно 20 мг Мангану, причому в кістках – 43%, а решта – в тканинах і мозку. Він входить до складу продуктів харчування – найбільше його в крупах, борошні (8 – 12 мг/кг), малині, смородині, журавлині (4 – 6 мг/кг), капусті, горосі, шпинаті (2,6 – 2,3 мг/кг).
При дефіциті цього мікроелемента порушується фосфорно – кальцієвий обмін, що призводить до виникнення рахіту, як і при нестачі в організмі вітаміну D. Манган прискорює процес утворення антитіл, які знешкоджують чужі для організму білки (віруси, бактерії), посилює синтез гормонів щитоподібної залози (тироксину, трийодтироніну), позитивно впливає на засвоєння йоду, тому рівень Мангану в крові пов’язують з виникненням ендемічного зобу.
Враховуючи багатогранну фізіологічну дію Мангану, його сполуки використовують в медичній практиці при невритах (у комплексі з полівітамінами) і в разі захворювання кровотворних органів (разом зі сполуками Кобальту і Купруму).
У разі надлишкового надходження в організм цього біоелемента в умовах промислового виробництва (хронічна інтоксикація) виникають тяжкі розлади рухової активності (синдром паркінсонізму)
Кобальт. Вміст йонів Кобальту в організмі становить 4 ∙10-6 % маси тіла, його добова потреба 0,3 мг. Як незамінний мікроелемент, він входить до складу еритроцитів та металопротеїнів, що є компонентами тканини внутрішніх органів – печінки, нирок, підшлункової залоз.
Його біологічна роль тісно пов’язана з функціонуванням ряду ферментів та гормонів, зокрема Кобальт бере участь у синтезі гормонів щитоподібної залози – тироксину і трийодтироніну, активує такі ферменти як карбоангідразу та карбопепсидазу.
Встановлено позитивний вплив йонів Кобальту на білковий, вуглеводний, ліпідний та мінеральний обміни, а також на обмін аскорбінової кислоти та синтез вітаміну РР (ніацину).
Залежно від вмісту в біосистемах, Кобальт може виступати як активатор, так і інгібітор тих ферментних систем, в основі функціонування яких лежать окисно – відновні процеси.
Йон Со2+ входить до складу біокомплексу ціанокобаламіну (вітаміну В12), який є ефективним протианемічним засобом, оскільки він істотно впливає на утворення еритроцитів та синтез гемоглобіну крові (гемопоез). У достатній кількості цей вітамін надходить в організм з м’ясними та молочними продуктами (добова потреба 2 мг). Внаслідок порушення його всмоктування виникає мегалобластична (В12 – дефіцитна) анемія. Ознаки цього захворювання зв’язані з недокрів’ям, ураженням нервової системи та травного каналу.
Надлишок кобальту в організмі також шкідливий, оскільки йони Кобальту сповільнюють адсорбцію йонів Fe2+, блокуючи його транспортні системи. Внаслідок цього виникає поліцитемія – захворювання крові, що характеризується збільшенням кількості еритроцитів та гемоглобіну.
Кобальт ефективно діє на біосистеми на наявності в організмі достатніх запасів Феруму та Купруму. Під впливом Кобальту підвищується всмоктування Феруму і використання його в процесах утворення гемоглобіну.
Молібден є одним із важких металів, виявлених в організмі людини. Відповідно до електронної конфігурації [Kr]4d55s1, він виявляє вісім різних ступенів окиснення, проте в біосистемах міститься у вигляді йонів Мо+5, Мо+6 і рідше Мо+3 та Мо+4. Різноманітність форм існування Молібдену є причиною того, що такий важкий елемент використовується для побудови деяких структур живого організму.
Основна біологічна функція, яку виконує цей мікроелемент, полягає у зв’язуванні неорганічного азоту. Зв’язаний азот використовується в процесах біосинтезу білків, нуклеїнових кислот, ферментів та інших нітрогеновмісних органічних сполук.
Молібден входить до складу деяких ферментів та ензимів, що беруть участь у засвоєнні азоту. Слід зазначити, що в малих дозах Молібден позитивно впливає на синтез гемоглобіну та сприяє нагромадженню в організмі вітамінів С і В12.
Дуже важливим чинником є баланс Молібдену в організмі. У мікродозах його сполуки, підсилюючи фагоцитарну активність крові, впливають на імунний захист організму. При підвищенні рівня Молібдену порушується пуриновий обмін і розвивається ендемічна (молібденова) подагра, яка зв’язана з утворенням і відкладенням сечової кислоти в тканинах, що призводить до деформування суглобів.
Добова потреба організму в Молібдені менша порівняно з іншими біметалами і становить приблизно 0,1 – 0,3 мг.
Доведено, що біологічна роль Молібдену тісно пов’язана з вмістом в організмі купру му. Ці елементи є антагоністами, оскільки надлишок Молібдену викликає зменшення концентрації Купруму. Антагонізм мікроелементів, зокрема Мо – Си, використовують у терапевтичній практиці. Для зменшення токсичної дії Молібдену в організм вводять розчинні солі Купруму, що призводить до утворення малорозчинної солі купрум молібдату СuМоО4 і виведення останнього з організму.
Хром. Цей біоелемент, що за вмістом в організмі належить до мікроелементів, відіграє важливу роль у функціонуванні біосистем. Він впливає на обмін вуглеводів, ліпідів та нуклеїнових кислот, активує дію інсуліну, входить до складу ферментів – трипсину і трансферину.
Доведено, що вміст Хрому в крові знижується при старінні або виснаженні організму. Поліпшуючи загальний обмін речовин, його сполуки сповільнюють процес старіння організму. Це було доведено дослідами на тваринах; тварини, яким до кормів додавали сполуки тривалентного Хрому, жили довше, ніж тварини контрольних груп.
У медичній практиці для лікування діабету використовують хром піколінат, який додають до комплексних препаратів з мікроелементами та вітамінами.
Серед відомих сполук Хрому найменш токсичними є сполуки Хрому (ІІІ), сполуки шестивалентного Хрому – хромати (Me2CrO4) та дихромати (Me2Cr2O7) є токсичними. У великих дозах Хром (ІІІ) теж токсичний, спостерігаються захворювання шкіри і слизових оболонок, хронічні катари верхніх дихальних шляхів, емфізема, а іноді рак легень.
Добова потреба Хрому становить 0,05 – 2,5 мг. Багаті на Хром такі продукти харчування, як чай, шпинат, оселедці, вівсяна крупа, печінка, яловичина.
Надлишок цього елемента в організмі викликає пошкодження легеневої тканини та розвиток злоякісних пухлин.
Нікол. Найбільший вміст цього біоелемента виявлено у підшлунковій залозі, печінці, шкірі та рогівці ока. Загальний вміст Ніколу в організмі становить приблизно 2 ∙10-6% мас.
Біологічна роль цього мікроелемента була встановлена нещодавно, коли його вперше виявили у складі ферменту уреази, що каталізує розкладання сечовини на амоніак і вуглекислий газ. Крім того, Нікол виступає активатором таких ферментів, як ангідраза, карбоксилаза, трипсин. Він прискорює регенерацію білків, поліпшує процес пігментації шкіри, впливає на обмін вуглеводів та морфологію крові, оскільки нормалізує в ній вміст гемоглобіну.
Вміст Нікола у крові людини зменшується з віком і при анеміях. Проте його рівень майже вдвоє підвищується при інфаркті міокарда, що може бути додатковим діагностичним критерієм цього захворювання.
Ванадій – ще недостатньо вивчений елемент. В організмі дорослої людини міститься приблизно 10 – 25 мг Ванадію, що відповідає масовій частці 5 ∙10-5%. Більша частина Ванадію входить до складу кісток, зубів та жирової тканини.
Виділено металопротеїн – гемованадин, який містить цей хімічний елемент. Гемованадин може виконувати функцію зв’язування кисню, причому в ролі групи, що приєднує кисень, виступає йон Ванадію.
Дослідження на тваринах показали, що при додаванні до їх раціону солей Ванадію поліпшується мінералізація кісток і зубів, знижується відсоток захворювання карієсом зубів.
Ванадій виступає каталізатором деяких окисно – відновних процесів, що відбуваються в організмі. Він підвищує активність пероксидази, каталази, карбоангідрази та ряду ферментів, що регулюють процес дихання тканин. Є відомості про його позитивний вплив на обмін вуглеводів та жирів. Ванадій гальмує синтез холестерину та пригнічує ріст мікобактерій туберкульозу в організмі. Він прискорює процес регенерації еритроцитів та посилює дію Феруму при анемії, тобто в даному разі виявляється синергізм біоелементів. Цей процес полягає у збільшенні активності одного металічного елемента (у даному разі Феруму) за наявності іншого (Ванадію).
Крім того, Ванадій є важливим біоелементом для життя тварин. При дефіциті цього елемента сповільнюється ріст тварин і виживання потомства.
Металічний ванадій широко використовують для виготовлення сплавів, які застосовують у зубопротезній техніці.
Титан постійно міститься у тканинах (загальний вміст в організмі
10-6%) і концентрується переважно в печінці та залозах внутрішньої секреції (щитоподібній залозі, наднирниках).
Цей мікроелемент, як і Ванадій, бере участь у формуванні кісток, впливає на збільшення кількості еритроцитів у крові, активує процес синтезу гемоглобіну, проте його біологічна роль до кінця ще не з’ясована.
У вигляді простої речовини титан входить дот складу хромонікелевих сплавів і використовується в зубопротезній практиці для виготовлення коронок.
Кадмій міститься в організмі в малих кількостях, переважно концентрується в нирках і печінці. Він входить до складу деяких ферментів і активує дію деяких з них, проте дію більшості ферментних систем Кадмій гальмує.
У більших дозах Кадмій отруйний, оскільки пошкоджує клітини нирок та печінки, викликає утворення злоякісних пухлин. Віднесення його до біогенних елементів є сумнівним.
Меркурій – це слідовий елемент, його біологічна роль не вивчена, проте сполуки цього елемента є дуже токсичними. Утворення навіть при кімнатній температурі парів ртуті може викликати важкі отруєння. При цьому найбільш виражені симптоми ураження дихальних шляхів, спостерігається токсичний набряк легенів. При пероральному отруєнні вражаються шлунково – кишковий тракт і нирки. Дуже отруйні і сполуки Меркурію, наприклад сулема: Hg2Cl2.
Засоби першої допомоги – молоко, слизові відвари, але без кухонної солі, яка може взаємодіяти зі сполуками Меркурію і переводити їх у добре розчинну сулему, ускладнюючи отруєння.
Отже, дослідження біологічної ролі хімічних елементів, з’ясування їх структури та механізму дії має велике значення для одержання нових ефективних лікарських засобів. Опрацювання сучасних методів лікування та створення наукових рекомендацій щодо здорового способу життя людини. Для підтримання нормальної життєдіяльності організму потрібна не тільки вода як розчинник, продукти харчування (білки, жири, вуглеводи), різноманітні вітаміни, але й певний набір макро- і мікроелементів, які беруть участь у функціонуванні численних біосистем.
· Ферум (ІІ) сульфат гептагідрат FeSO4 ∙7H2O, ферум лактат тригідрат (СН3СН(ОН)СОО)2Fe ∙3H2O, ферум аскорбінат застосовують для лікування ферумдефіцитних анемій.
· Цинк сульфат ZnSO4 використовують у вигляді розчинів з масовою часткою 0,1 – 0,25% для лікування очних хвороб. Ця сполука входить до складу деяких стоматологічних цементів типу «Дентин», «Вікасол» та препарату цинктерал, який використовують у дерматології. Цинк оксид ZnO застосовують у дерматологічній практиці у вигляді мазей, паст і присипок. Суспензію цинк інсулін, що складається з цинк хлориду та інсуліну, використовують для ін’єкцій при цукровому діабеті. Вітамін С- Плюс (вітамін С з Цинком) рекомендують для посилення імунітету, нормалізації кровотворення.
· Хром піколінат (50 – 100 мкг) використовують у разі порушень вуглеводного та жирового обмінів) хром (ІІІ) оксид Cr2O3 входить до складу деяких стоматологічних паст.
· Амоній або натрій молібдат (NH4)2MoО4 (Na2MoO4) у мікродозах вводять до складу різних вітамінних комплексів («Дуовіт»), враховуючи той факт, що Молібден підвищує фагоцитарну функцію крові.
· Манган (ІІ) сульфат та хлорид MnSO4 + MnCl2 як мінеральні добавки входять до складу різних полівітамінів, наприклад, «Кальцеміну», «Теравіту».Калій перманганат KMnO4 у вигляді розведених розчинів застосовують як протимікробний препарат.
· Вітамін В12 (ціанокобаламін) використовують для лікування мегалобластичної анемії, дистрофії та при захворюваннях печінки.
· Радіоактивний нуклід Кобальту 60Со застосовують для лікування злоякісних пухлин радіоактивним випромінюванням (так звані «кобальтові гармати»)
· Купрум (ІІ) сульфат у вигляді розведених розчинів для внутрішнього застосування; 5% - вий розчин – для повязок при опіках білим фосфором, а 2% – вий розчин – внутрішньо при отруєнні білим фосфором.
· Аргентум (І) нітрат має в’яжучу, підсушуючу та протизапальну дію. Зовнішньо він використовується у вигляді 1 -10% розчинів або мазей, а внутрішньо – 0,05%-вий розчин при виразці шлунку та гастритах.
Крім того, широко використовуються полівітамінні комплексні препарати з мінеральними добавками: «Мульті – табс», «Юнікап», «Вітрум», «Активан», «Дуовіт», краплі «Береш Плюс»
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 6094; Нарушение авторских прав?; Мы поможем в написании вашей работы!