
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Інші життєво необхідні р – елементи
|
|
|
|
План
Тема: Біогенні р – елементи, їх біологічна роль та застосування в медицині
Позааудиторна самостійна робота №1
Контрольні запитання
1. Що таке СУБД?
2. Об’єкти СУБД.
3. Створення таблиць БД.
4. Як створюється таблиця?
5. У яких режимах може перебувати таблиця?
6. Що таке запис?
7. Відкрийте конструктор таблиці.
8. Що таке поле?
9. Основні типи полів.
10. Як вносяться зміни в структуру таблиці.
1.Поняття про елементи – органогени, їх біологічна роль.
2.Лікарські засоби, що містять елементи -органогени.
3.Інші життєво необхідні р- елементи.
Час виконання: 1 година
Мета роботи: розглянути біологічну роль і застосування р – елементів у медицині.
Шість хімічних елементів, які становлять 97,5% загальної маси організму, належать до органогенних елементів. Вони входять до складу білків, ліпідів, ферментів, гормонів, вітамінів, нуклеїнових кислот, а також води.
Розглянемо детальніше біологічну роль, фізіологічну дію р- елементів та деякі хімічні властивості, пов’язані з виконанням певних функцій в організмі.
Карбону належить головна роль в утворенні біосистем. Атоми Карбону, завдяки особливій будові верхнього енергетичного рівня (чотири валентні електрони в збудженому стані розміщені на 2s12p3 орбіталях, здатних до sp3-, sp2- i sp –гібридизації), утворюють міцні зв’язки – прості, подвійні або потрійні. Вони сполучаються між собою у лінійні, розгалужені та циклічні структури, причому можуть замикатися в цикли як між собою, так і за участю гетеро атомів (N, P, O, S), утворюючи карбоциклічні та гетероциклічні сполуки.
У хімічних сполуках Карбон може виявляти різні ступені окиснення: -4 (СН4, SiC), -1 (CaC2, Ag2C2), 0 (Cграфіт, Салмаз), +2 (СО, HCN), +4 (СО2, Н2СО3), причому в складі однієї молекули можуть знаходитися атоми з різними ступенями окиснення. Це також є причиною багатоманітності сполук даного елемента.
Неорганічними сполуками Карбону є його бінарні сполуки з металами (карбіди – СаС2, АІ4С3 та ін.) та неметалами (CS2, CF4, SiC), оксиди (СО і СО2), карбонатна кислота та її солі (карбонати і гідрогенкарбонати), ціанідна і тіоціонатна кислоти та солі цих кислот – ціаніди, тіоціанати (роданіди) та ін.
Карбон (ІІ) оксид, або чадний газ СО – це безбарвний, дуже отруйний газ, кий одержують при неповному згорянні різних видів палива
2С + О2 = 2СО.
У хімічному відношенні це несолетворний оксид, який за звичайних умов не реагує з водою, кислотами, лугами. Тільки при пропусканні його крізь розплав лугів утворюються солі метанової кислоти:
СО + КОН 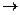 НСООК.
НСООК.
З гемвмісними білками, зокрема гемоглобіном крові, карбон (ІІ) оксид утворює карб оксигемоглобін – стійку комплексну сполуку, яка на відміну від гемоглобіну не може зв’язувати і переносити кисень від легень до тканин. Тому вже при незначній концентрації СО в повітрі (0,07 % об.) наступає отруєння людини. Для захисту організму від чадного газу використовують спеціальні протигази, обладнані гопкалітовим патроном. Цей патрон заповнюють сумішшю оксидів MnO2 i CuO, які можуть реагувати з карбон (ІІ) оксидом. Антидотом при отруєннях чадним газом є кисень, надлишкову концентрацію якого створюють у спеціальній барокамері (метод оксигенобаротерапії).
Гідроген ціанід HCN (стара назва – ціаністий водень) за звичайних умов існує у вигляді рідини, яка добре змішується з водою, утворюючи ціанідну або синильну кислоту. Ця кислота та її солі (ціаніди) – дуже отруйні сполуки. Навіть у мізерних дозах (ГДК – 0,01 мг/м3) вони смертельно діють на організм, що пояснюється їх високою здатністю до комплексоутворення, особливо з d – елементами. Ціанід – йони легко зв’язуються з катіонами Феруму (ІІ), що входять до складу цитохромів – групи ферментів ланцюга дихання. Оскільки вміст цитохромів в організмі менший, ніж гемоглобіну, то стає зрозумілою причина більшої токсичності синильної кислоти порівняно з чадним газом (смертельна доза – 0,05 г).
Проте у мікро кількостях ціанід – йони утворюються в організмі і використовуються ним для побудови деяких біоструктур, зокрема ціанокобаламіну (вітаміну В12). У молекулі цього вітаміну ціанід – йони виконують роль лігандів у складі хелатного комплексу.
Ціанідна кислота та її солі як продукти обміну виділяються з організму з повітрям та сечею у вигляді неотруйного роданіди – йона SCN -, який утворюється за реакцією:
CN - + S = SCN –
При отруєнні ціанідами застосовують кисень, метгемоглобіноутворювачі (амілнітрат, натрію нітрит) або натрію тіосульфат, який реагує з калій ціанідом за рівнянням:
KCN + Na2S2O3 = KSCN + Na2CO3.
Важливою сполукою Карбону (ІV) є діоксид карбону СО2 (вуглекислий газ), який є кінцевим продуктом біологічного окиснення в клітинах різних біосубстратів – глюкози, ліпідів та, меншою мірою, білків.
У хімічному відношенні СО2 - кислотний оксид, який відповідає карбонатній кислоті Н2СО3. Це слабка кислота, яка утворює середні та кислі солі – відповідно карбонати та гідрогенкарбонати. У розчині вона дисоціює ступінчасто:
Н2СО3 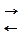 Н + + НСО3- І стадія
Н + + НСО3- І стадія
НСО3- 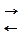 Н + + СО32- ІІ стадія
Н + + СО32- ІІ стадія
Процес дисоціації практично відбувається за першою стадією, тому в плазмі крові присутні гідрогенкарбонат – йони НСО3-, які в суміші з карбонатною кислотою утворюють карбонатну буферну систему крові.
Отже, одна частина вуглекислого газу зв’язується (гід ратується), а інша – виділяється з організму шляхом дифузії. З клітин СО2 спочатку дифундує в міжклітинну рідину, а потім у плазму, де частково розчиняється у воді. Решта його проникає в еритроцити, в яких СО2 зв’язується з білковою частиною молекули гемоглобіну – глобіном, утворюючи нестійкий карбамін
R – NH2 + CO2 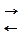 R – NH – COOH
R – NH – COOH
Зв’язаний вуглекислий газ виноситься еритроцитами до альвеол легень, де він виділяється з повітрям, яке ми видихаємо.
Вміст вуглекислого газу в атмосфері становить близько 0,03 % за об’ємом. Він відіграє важливу роль у підтриманні певного температурного режиму на поверхні Землі, оскільки молекули вуглекислого газу здатні вбирати УФ – випромінювання, запобігаючи витоку тепла за її межі. Проте, через активну виробничу діяльність людства спостерігається постійне збільшення концентрації вуглекислого газу в атмосфері, що призводить до глобальних кліматичних змін („парникового ефекту”).
Гідроген та Оксиген. В організмі масова частка Гідрогену 9,7%, Оксигену – 62,4%. Основна маса цих елементів перебуває у ковалентно зв’язаному стані з іншими елементами – органогенами. Атоми Гідрогену можуть втрачати електрон, утворюючи протон Н +.Протони у водних розчинах біосистем відіграють важливу роль. Вони беруть участь в окисно – відновних процесах, визначають кислотні властивості речовин, підтримують кислотно – основну рівновагу організму, каталізують реакції гідролізу харчових продуктів.
Найважливішою і дуже поширеною у природі сполукою Гідрогену є вода Н2О (гідроген оксид), оскільки ¾ земної поверхні вкрито водою. Вода має полярну молекулу і тому є добрим розчинником полярних неорганічних та органічних речовин. Загальний вміст води в організмі (в розрахунку на середню масу тіла 70 кг) становить 42 кг або 60%. Причому 2/3 цієї кількості знаходиться у внутрішньоклітинних рідинах, а решта – в позаклітинних. Втрата організмом 2/3 позаклітинної води є смертельною у зв’язку з порушенням нормального електролітного балансу.
У медичній практиці використовують очищену (дистильовану) воду для приготування лікарських форм у розчинах та воду для ін’єкцій, або апірогенну воду - для приготування розчинів, які вводять парентерально.
Гідроген пероксид у вигляді концентрованого розчину з масовою часткою Н2О2 30% (пергідроль) застосовують для лікування гнійних ран, а розчин з масовою часткою 3% використовують як дезінфікуючий засіб для промивання ран та полоскань при ангіні та стоматитах тощо.
Особливо велике значення для функціонування біосистем має Оксиген. Як елемент – органоген він входить до складу переважної більшості органічних біомолекул. Без молекулярного кисню не може функціонувати жодна клітина живих організмів, оскільки він бере участь у всіх видах обміну речовин. Кисень є окисником в усіх окисно – відновних процесах, що відбуваються в організмі. Він незамінний для здійснення одного з найважливіших життєвих процесів – дихання.
У живих організмах Сульфур входить до складу амінокислот(цистеїн, цистин, метіонін), ліпідів, а також деяких вітамінів (В1, Н) та біорегуляторів (інсулін) у ступені окиснення -2. Найбільше Сульфуру в кератині, волоссі, кістках та нервовій тканині.
Сірка і сполуки Сульфуру. Очищена сірка має протимікробну і протигельмінтну дію, пригнічує діяльність глистів і сприяє виведенню їх з організму. Вона входить до складу мазей, які застосовуються в дерматології для лікування деяких шкірних захворювань.
З групи сульфаніламідних препаратів у медичній практиці як протимікробні засоби використовують стрептоцид, норсульфазол, етазол, сульфазин, бактрим та ін. Ці препарати містять у молекулі сульфамідну групу -SO2NH2, є похідними сульфаніламіду і мають таку будову:
R
│
NH2 – С6Н4- SO2 – N- H,
де – R – залишки гетероциклічної природи (піримідиновий, тіодіазольний тощо).
Заслуговує на увагу лікарський препарат диметилсульфоксид H3C – SO – CH3 (димексид). Він містить у молекулі як неполярні (СН3), так і полярну (SO) групи. Тому в ньому розчиняються неполярні органічні речовини та йонні сполуки. Димексид добре проникає через біологічні мембрани.
Нітроген є обов’язковою складовою частиною всіх білків, відіграє важливу оль в обміні речовин, входить до складу гетероциклічних сполук, які є компонентами амінокислот та нуклеїнових кислот.
Сполуки Нітрогену використовують у вигляді естерів нітратної кислоти – нітрогліцерин, нітросорбід, сустак. Це коронаролітики, що здатні розширювати спазмовані судини серця, і тому їх використовують для лікування серцевих захворювань. Комплексну сполуку сечовини і гідроген пероксиду – гідроперит СО(NH2)2 ∙H2O2 застосовують у вигляді таблеток як антисептичний засіб.
Із неорганічних сполук Нітрогену в медичній практиці використовують також нітроген(І) оксид N2O, або „веселильний газ”. У малих дозах він викликає стан сонливості і сп’яніння, а у більших – наркоз. Розчин амоній гідроксиду (нашатирний спирт) використовують як збуджуючий засіб при непритомному стані. Амоній хлорид NH4Cl застосовують як сечогінний засіб
Фосфор називають елементом життя і мислення, оскільки він відіграє істотну роль в обміні речовин та енергії. У вигляді фосфат- йонів входить до складу нуклеотидів, які є мономерними одиницями нуклеїнових кислот.
Зв’язування фосфатної кислоти біоорганічними молекулами називають біологічним фосфорилуванням, а процес утворення АТФ з АДФ та неорганічного фосфату дістав назву окисного фосфорилування.
До важливих органічних сполук Фосфору належать також біологічно активні речовини: креатин фосфат, фосфопротеїни, фосфоліпіди клітинних мембран.
Сполуки Фосфору, зокрема аденозинтрифосфат (АТФ) та креатинфосфат (неотон), широко вживають як енергетичні препарати при дистрофії м’язів, атонії внутрішніх органів та міокардіодистрофії. Кальцій гліцерофосфат – це загальнозміцнюючий і тонізуючий засіб при перевтомах, виснаженні нервової системи і рахіті. Добре стимулює кровотворення, посилює ріст і розвиток кісткової тканини, поліпшує функцію нервової системи органічний препарат Фосфору, який називають фітином.
Для лікування злоякісних пухлин знаходять застосування препарати з групи фосфорорганічних сполук, наприклад циклофосфан, тіофосфамід, дипін, тіодипін та ін., а при глаукомі використовують армін, фосфакол.
Малорозчинні фосфати цинку Zn3(PO4)2 та алюмінію АІРО4 застосовують у стоматології як пломбувальний матеріал, їх називають фосфатцементами.
Селен – важливий, життєво необхідний елемент. Входить до складу ферменту глутатіонпероксидази, яка дезактивує гідро пероксиди ліпідів, захищаючи клітинні мембрани від оксидаційної дії вільних радикалів та йонів важких металів. Тому препарати Селену належать до групи речовин, які називають антиоксидантами. До цієї групи входять аскорбінова, лимонна або нікотинова кислоти, вітаміни груп Е, К,  -каротин та деякі мікроелементи - Se, Cu, Zn.
-каротин та деякі мікроелементи - Se, Cu, Zn.
Селен – р – елемент VI групи є хімічним аналогом Сульфур, тому він може заміщувати цей елемент у складі дисульфід них містків та сульфгідрильних груп. Тому Селен виконує захисну функцію не тільки від дії вільних радикалів, але й захищає білки від токсичної дії ендогенного гідроген пероксиду та катіонів важких металів.
Цей елемент переважно нагромаджується у волоссі та нігтях. Дещо більші його кількості виявлено і в сітківці ока, оскільки він бере участь у перетворенні світлової енергії на енергію електричного потенціалу зорового нерва. Селен впливає на функцію статевих залоз і в мікро дозах необхідний для нормального перебігу вагітності. Визначена добова потреба Селену вона становить 70 мкг для дорослих і 50 мкг для дітей.
У профілактиці та лікуванні деяких інфекційних захворювань або при порушенні зору рекомендують препарати Три – Ві та Три – Ві – Плюс, які містять вітаміни (С,Е), 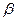 - каротин та мікроелементи - Se, Cu, Zn.
- каротин та мікроелементи - Se, Cu, Zn.
Хлор належить до макроелементів, оскільки його вміст в організмі дорівнює приблизно 8 ·10-2%. Добова потреба організму (4 – 6 г) постійно поповнюється за рахунок вживання кухонної солі.
В хімічних сполуках Хлор характеризується змінними ступенями окиснення (-1, 0, +1,+3, +5, +7), проте в організмі він існує тільки у формі йону Сl-. Хлорид – йони знаходяться переважно у позаклітинних рідинах – плазмі крові, лімфі тощо. Вони беруть участь у процесі гальмування біопотенціалів дії, регулюванні осмотичного тиску та у водно – електролітному обміні. Вони сприяють відкладанню глікогену в печінці, стимулюються дію ферменту амілази, входять до складу шлункового соку, масова частка НСl у якому становить 0,5 – 0,9%.
У медичній практиці застосовують розведений розчин хлоридної кислоти в разі зниженої кислотності шлункового соку. Кислота поліпшує всмоктування йонів Феруму з кишок у кров і тому її призначають у комплексі з препаратами Феруму при ферумдефіцитних анеміях. Крім того, хлоридна кислота виконує каталітичну функцію в реакції гідролізу пептидних зв’язків. Вона має дезінфікуючу дію, оскільки за підвищеної кислотності мікроорганізми гинуть.
Атоми Хлору входять до складу деяких наркотичних і анестезуючих препаратів (хлороформу, хлоретилу, трилену).
У сільському господарстві в якості пестицидів використовують хлорвмісні органічні сполуки (хлорофос, ДДТ, гексахлоран, гексахлорофен, хлородан та ін.).
Промислове виробництво цих сполук пов’язане з утворенням дуже токсичних побічних продуктів, які називають діоксинами. Вони мають кумулятивний токсичний ефект, оскільки нагромаджуються в жирових тканинах тварин і з продуктами харчування потрапляють в організм людини. Діоксини згубно діють на молекули РНК і ДНК, які є носіями генетичної спадковості людини і тварин.
Хлор у формі простої речовини – це отруйний газ, який діє на слизову оболонку дихальних шляхів. Як сильний окисник він легко взаємодіє з аміногрупами амінокислот мікробних клітин і руйнує їх. Його використовують для знезараження питної води, дезінфекції приміщень, відбілювання тканин. Якщо в питну воду потрапляють домішки ароматичних сполук, то в процесі її хлорування можливе утворення токсичних діоксинів. Тому в багатьох країнах воду не хлорують, а озонують.
Йод відносять до біогенних елементів, оскільки він постійно міститься в організмі в кількості 25 – 50 мг. Основна маса Йоду знаходиться в щитоподібній залозі, м’язах, шкірі та кістках. Добова потреба організму в сполуках Йоду 0,2 мг.
Біологічна роль цього елементу полягає в тому, що він бере участь у синтезі гормонів щитоподібної залози – тироксину та трийодтироніну.
Ці гормони посилюють енергообмін клітин, впливають на ріст і диференціацію тканин, обмін вуглеводів, підвищують збудливість нервової системи. Надлишок їх в організмі викликає базедову хворобу, або тиреотоксикоз.
Йодид – йони беруть участь у водно – електролітному обміні, впливаючи на концентрацію йонів Натрію і Калію. Доведено, що Йод позитивно діє на фагоцитарну активність лейкоцитів крові, підвищує активність деяких статевих гормонів. При хронічній недостачі його в продуктах харчування та питній воді виникає ендемічний зоб.
Йод та його сполуки застосовують у медичній практиці, причому розрізняють три основні групи препаратів цього елемента6
а) препарати, що містять І2 (спиртовий розчин йоду 5% використовують як антисептичний засіб для обробки ран, підготовки операційного поля тощо, а розчин Люголя – при ангінах).
б) препарати, що містять І-, наприклад, у солях КІ, NaI використовують для профілактики ендемічного зобу.
в) органічні сполуки, які здатні відщеплювати йод (йодоформ, йодинол), зокрема препарат „Мікройод” використовують для лікування гіпертиреозів. Синтетичні сполуки, що містять йод (трийодтироніну гідрохлорид, дийодтирозин) застосовуються при гіпотиреозі.
Бром. Загальний вміст в організмі Брому такий самий, як Йоду. Найбільше його міститься в кірковій частині нирок, гіпофізі, щитоподібній залозі. Добова потреба організму становить 0,8 мг.
Роль Брому в біологічних процесах до кінця не з’ясована. Відомо, що він посилює процеси гальмування в нейронах кори головного мозку і тому препарати Брому у вигляді солей бромідної кислоти (NaBr, KBr) застосовують при безсонні, для лікуванні неврозів, при неврастенії. При підвищеній збудливості та неврозах серця використовують бромкамфору, яка заспокійливо діє на ЦНС і поліпшує роботу серця.
Флуор. З числа мікроелементів Флуор має найвужчу межу між дозою необхідною і шкідливою для організму. Основна біологічна функція цього елемента – це участь в процесах утворення кісток, формування емалі зубів і дентину. Він входить до складу цих тканин у вигляді фторапатиту Ca5F(PO4)3. Тому у мікро кількостях Флуор використовують для запобігання карієсу зубів, збагачуючи питну воду розчинними сполуками Флуору або додаючи фториди до зубних паст. Для поліпшення процесу формування тканини зубів у дітей та для лікування карієсу використовують препарат „Вітафтор”.
Проте фторид – йони можуть інгібувати ферменти, які беруть участь в процесах утворення енергії, гальмуючи процеси клітинного дихання Надлишок цих йонів в організмі викликає флюороз – хронічну хворобу, яка призводить до гіпоплазії емалі зубів.
Бор концентрується переважно у щитоподібній залозі, легенях, кістковому мозку, печінці, селезінці. Його загальний вміст в організмі становить 10-5%, добова потреба 1,5 мг. Бор – необхідний для організму елемент, що бере участь у вуглеводному обміні, посилює дію інсуліну. Сполуки Бору, взаємодіючи з деякими біологічно активними речовинами, сповільнюють їх дію, зокрема амілази, вітамінів групи В, а також гальмують процес окиснення адреналіну. Тому при систематичному вживанні продуктів харчування з підвищеним вмістом Бору порушується обмін вуглеводів та білків і розвиваються ендемічні ентерити.
Неорганічні сполуки Бору характеризуються антисептичними та протизапальними властивостями. Так, водний розчин боратної кислоти Н3ВО3 використовують для промивання очей, а у вигляді мазі – при деяких шкірних захворюваннях. Натрій тетраборат декагідрат Na2B4O7∙10H2O(бура) застосовують як антисептик. Боратна кислота, її ангідрид та цитрат бору в комплексі з іншими фармацевтичними препаратами знаходять застосування для лікування захворювань, викликаних порушеннями обмінних процесів в організмі.
Силіцій – типовий неметал ІV групи. Його сполуки мають здатність впливати на формування і нормальне функціонування епітеліальних і сполучних тканин, надаючи їм міцності та еластичності. Доведено, що Силіцій справляє вплив на діяльність підшлункової залози, перешкоджає проникненню ліпідів у плазму крові та відкладанню їх на стінках кровоносних судин. Із порушенням обміну цього елемента пов’язують такі захворювання як ревматизм, гіпертонію, виразку шлунка.
Силіцій не відносять до життєво необхідних елементів у харчуванні, тому що він у достатній кількості надходить з їжею. Проте надмірне потрапляння Силіцій (ІV) оксиду в органи дихання, зокрема з промисловим пилом, викликає силікоз. Під дією нерозчинних у воді частинок SiO2 руйнуються фагоцити і пошкоджується легенева тканина.
Алюміній - один з найпоширеніших металів земної кори. Його сполуки виявляють амфотерні властивості. Алюміній відносять до незамінних мікроелементів (загальний вміст в організмі 10-5%). Поступає в організм з продуктами харчування та частково з водою, добова потреба 45 – 50 мг. Нагромаджується у кістках, печінці, легенях, нирках, головному мозку. Алюміній сприяє розвитку і регенерації епітеліальної, кісткової і сполучної тканин, бере участь в обміні фосфоровмісних сполук.
При підвищеному вмісті в організмі сполук Алюмінію спостерігається порушення рівноваги реакцій фосфорилювання, рівень АТФ у клітинах падає, що призводить до порушення тканинного метаболізму. Крім того, підвищений вміст в організмі розчинних сполук Алюмінію впливає на функцію ЦНС, порушуючи передачу нервових імпульсів.
Сполуки Алюмінію мають кровоспинні, протизапальні та антацидні властивості і тому їх здавна використовують в медицині. Наприклад, алюміній гідроксид застосовують при підвищеній кислотності шлункового соку як у чистому вигляді, так і у сумішах з магній оксидом (альмагель) або з магній гідроксидом (маалокс). У вигляді паст, мазей, присипок алюмокалієвий галун KAl(SO4)2· 12H2O використовують при запальних захворюваннях слизових оболонок і шкіри.. Препарат алюгастрин NaAl(OH)2CO3 характеризується доброю захисною дією на слизову оболонку шлунка і тому його призначають при виразковій хворобі.
Станум є обов’язковою складовою кісток (0,08%), печінки (0,06%), легень. Його загальний вміст в організмі 17 мг.
Біологічна роль цього елемента вивчена ще недостатньо. Відомо, що в більших дозах сполуки Стануму (ІІ) інгібують деякі ферменти.
Людина з давніх часів контактує з оловом та його сплавами. Наприклад, олово входить до складу деяких припоїв. Сплави срібла, міді та олова використовують у стоматології для виробництва металевих пломбувальних матеріалів, які останнім часом здебільшого замінюють синтетичними полімерами.
Плюмбум нагромаджується у печінці, входить до складу трубчастих кісток. Він надходить в організм з їжею у кількості 100 – 150 мкг за добу. Біологічна функція цього елемента не зовсім з’ясована. Відомо, що у більших дозах Плюмбум і його сполуки токсичні. Вони потрапляють у довкілля в результаті виробничої діяльності людини та внаслідок використання автомобільного пального з добавками тетраетилплюмбуму. З питною водою та продуктами харчування йони Плюмбуму потрапляють в організм, де вони утворюють міцні малорозчинні сполуки з деякими групами амінокислот.
Надлишок Плюмбуму в організмі є причиною серйозних порушень ЦНС та механізмів синтезу гемоглобіну, пошкодження нирок, ШКТ. Хронічне отруєння свинцем і його сполуками називають сатурнізмом.
В медичній практиці препарати Плюмбуму використовують зовнішньо як зв’язуючий засіб при запальних захворюваннях шкіри та слизових оболонок.
Арсен в організмі знаходиться у незначних (слідових) кількостях. Найбільше його нагромаджується у печінці, нирках, селезінці, мозковій тканині та еритроцитах.
Арсен відносять до групи важливих мікроелементів, необхідних для життєдіяльності організму. В малих дозах його сполуки поліпшують процес кровотворення, беручи участь у синтезі гемоглобіну. Виявлено позитивний вплив сполук Арсену на окисно – відновні процеси та нуклеїновий обмін.
В більших дозах Арсен та його сполуки токсичні. Отруєння ним можливе при використанні деяких медикаментів, інсектицидів, фунгіцидів та на виробництві. Сполуки Арсену належать до сильних толових отрут. Вони інгібують ферменти, впливають на процеси в мітохондріях.
Сполуки Арсену здавна відомі як лікарські засоби. Препарат „Сальварсан” було вперше використано для лікування сифілісу П. Ерліхом. Арсен (ІІІ) оксид („білий миш’як”) використовують у стоматології для некротизації пульпи, а також призначають внутрішньо як засіб проти недокрів’я та неврастенії.
Солі арсенітної та арсенатної кислот (KAsO2 і Na2HAsO4∙7H2O) застосовують для загального зміцнення організму, оскільки вони стимулюють функцію спинного мозку та підвищують анаболічні процеси.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1586; Нарушение авторских прав?; Мы поможем в написании вашей работы!