
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
І рівень
План
Тема: Розчини. Фізіологічні розчини, їх склад та застосування.
Позааудиторна самостійна робота № 4
ІІІ рівень
ІІ рівень
І рівень
1.Який з чинників не є причиною порушення метало – лігандного гомеостазу:
а) нестача вітамінів;
б) надходження ксенобіотиків;
в) дефіцит біоелементів;
г) надлишок біоелементів.
2. Вказати формулу трилону Б:
а) NaЕДТА; б) Na2ЕДТА; в) Na2НТА; г) Сa2ЕДТА.
3.Яка з комплексних сполук платини використовується у медицині як протипухлинний засіб:
а) Cs2[Pt(CN)4F2]; б) Pt(NH3)2Br2; в) K[PtCl3(C2H4)]; г) Pt(NH3)2Cl2
4. Вказати назву сполуки, яка використовується при отруєннях солями Кальцію:
а) тетацин; б) комплексон Б; в) унітіол; г) хризолан.
5.Природні сполуки, які здатні утворювати комплекси з катіонами лужних і лужноземельних металів, називаються:
а) криптандами; б) «коронами»; в) кластерами; г) йонофорами.
6. Які з представників КС можуть утворювати халатні сполуки з радіонуклідом Стронцію:
а) йонофори; б) криптанди; в) «корони»; г) аміакати.
7.Які з КС належать до комплексонів:
а) ЕДТА; б) НТА; в) СаNa3ДТПА; г) карбоніли.
1.Роль води та розчинів в біології та медицині.
2.Осмос і осмотичний тиск, його біологічне значення.
3.Поняття про фізіологічні розчини та їх застосування..
Час виконання: 2 години
Мета роботи: ознайомитися з роллю розчинів у біології та медицині, розглянути склад і застосування фізіологічних розчинів.
Водні розчини – це найпоширеніші системи у живій і неживій природі. Оскільки вода є універсальним розчинником твердих, рідких і газоподібних речовин. Розчини відіграють винятково важливу роль у життєдіяльності будь – яких організмів. Саме у водному середовищі відбувається більшість хімічних реакцій, у тому числі й складні фізіологічні та біохімічні процеси (травлення їжі, всмоктування в кров поживних речовин та виведення з організму продуктів обміну тощо). Основні біологічні системи - плазма крові, лімфа, сеча, спинномозкова рідина – містять різні неорганічні та органічні речовини у розчиненому стані.
Добова потреба дорослої людини у воді становить в середньому 2,5 дм3, причому в організмі людини відбувається постійний обмін води і розчинених у ній речовин. Основна частина води організму (70%) міститься всередині клітин разом з катіонами Калію і фосфат – йонами; 23% - у міжклітинній рідині з йонами Натрію, хлорид – і гідрогенкарбонат – йонами; 7% - усередині кровоносних судин і плазми крові.
Дифузія – це самочинний процес вирівнювання концентрації речовини у всьому об’єму розчину, зумовлений тепловим рухом частинок розчиненої речовини і розчинника. Дифузія відбувається з розчину більшої концентрації розчиненої речовини у розчин з меншою концентрацією цієї речовини.
Розглянемо процес дифузії, коли між розчином і розчинником, або на межі двох розчинів різної концентрації, помістити напівпроникну мембрану. Напівпроникними є перегородки, крізь пори яких проходять тільки молекули розчинника і затримуються частинки розчиненої речовини. Такі властивості характерні для стінок клітин живих і рослинних організмів (стінок кишок, сечового міхура, шкіри, протоплазми), і штучно виготовлених органічних мембран (плівок з колодію, желатини, целофану). За наявності напівпроникної мембрани відбувається проникнення молекул розчинника у більш концентрований розчин. Односторонню дифузію молекул розчинника крізь напівпроникну мембрану з розчину з меншою концентрацією в розчин з більшою концентрацією, називають осмосом.
Осмос можна спостерігати у приладі, який називають осмометром. (рис. 1)
 Рис. 1. Схема осмометра: 1 – манометр; 2 – посудина з розчином; 3 – посудина з розчинником.
Рис. 1. Схема осмометра: 1 – манометр; 2 – посудина з розчином; 3 – посудина з розчинником.
Для цього у посудину (2) з напівпроникною мембраною наливають розчин і закривають корком, у який вставлена трубка, з’єднана з манометром (1). Осмометр занурюють у посудину з розчинником (3). У результаті дифузії розчинника із зовнішньої посудини всередину осмометра, рівень рідини в трубці буде підніматись, що створить надлишковий гідростатичний тиск р, який обчислюють за формулою
p = h 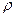 g,
g,
де h - надлишковий стовп рідини; 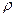 - густина рідини; g – прискорення сили земного тяжіння.
- густина рідини; g – прискорення сили земного тяжіння.
Поступово швидкість дифузії і гідростатичний тиск досягнуть таких величин, за яких кількість молекул розчинника, що переміщуються крізь мембрану в посудину (2) та із посудини (2) у посудину (3), вирівняються. Тобто настане осмотична рівновага. Надлишковий гідростатичний тиск у посудині з розчином, при якому встановлюється осмотична рівновага, називають осмотичним тиском. Величина осмотичного тиску визначається тим зовнішнім тиском, який треба прикласти до розчину, щоб осмос припинився.
Голландський хімік Я. Вант – Гофф (1887) запропонував для обчислення осмотичного тиску застосовувати газові закони: осмотичний тиск розчину дорівнює тому тиску, який учинила б розчинена речовина, перебуваючи за тієї ж температури у газоподібному стані і займаючи об’єм, однаковий з об’ємом розчину. Використовуючи об’єднане рівняння газового стану Менделєєва – Клапейрона:
pV = 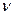 RT =
RT = 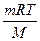 ,
,
Вант – Гофф вивів рівняння для визначення осмотичного тиску  :
:
 =
= 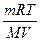 = CMRT,
= CMRT,
де  -осмотичний тиск розчину, кПа; СМ – молярна концентрація розчину, моль/л; R – універсальна газова стала (8,314 Дж/(моль*К); T - абсолютна температура, К.
-осмотичний тиск розчину, кПа; СМ – молярна концентрація розчину, моль/л; R – універсальна газова стала (8,314 Дж/(моль*К); T - абсолютна температура, К.
Наведене вище рівняння є математичним виразом закону осмотичного тиску Вант – Гоффа, який формулюють так: осмотичний тиск розчину прямо пропорційний його молярній концентрації та абсолютній температурі.
Відомо, що всі біологічні рідини є водними розчинами багатьох мінеральних і органічних речовин. Вони мають певний осмотичний тиск, який підтримується на відносно сталому рівні. Так, для плазми крові людини цей показник дорівнює 770-821 кПа (7,6-8,1 атм). На відміну від крові, осмотичний тиск сечі і поту коливається у ширших межах. Близько 60 % осмотичного тиску крові створюють наявні у ній йони Nа+ і СІ-, а значно меншу його частину зумовлюють білки. Тиск, що створюється високомолекулярними біологічно активними сполуками, називають онкотичним тиском. Він становить менше 0,5 % від загального осмотичного тиску (3,04-4,05 кПа або 0,03-0,04 атм) і на 80 % визначається альбумінами. Онкотичному тиску належить основна роль у механізмі надходження води у кров із тканинної рідини, тому що низькомолекулярні речовини плазми без перешкод проникають крізь стінки кровоносних капілярів і їх концентрація у крові і тканинній рідині практично однакова. Оскільки онкотичний тиск крові становить близько 4 кПа, а тканинної рідини та лімфи - приблизно 1,33 кПа, то за рахунок цієї різниці тисків вода надходить із лімфи у кров.
Завдяки тому, що стінки клітин мають властивості мембран, розподіл води в тканинах залежить від осмотичного тиску. Зокрема, стан осмотичної напруженості клітини, зумовлений підвищеним осмотичним тиском, називають тургором. Він забезпечує пружність та еластичність тканин. У рослин засушливих місцевостей осмотичний тиск високий, а у болотних рослин - порівняно низький.
Вода проникатиме у клітину доти, поки різниця осмотичного тиску між клітиною та середовищем не стане рівна нулю, або поки гідростатичний тиск у клітині, який збільшується в результаті набрякання клітини і розтягнення її оболонки, не зрівноважить осмотичного тиску.
У процесі регуляції осмотичного тиску беруть участь органи виділення, головним чином нирки і потові залози. Завдяки їм вода, що надходить в організм, і продукти метаболізму виводяться із сечею та потом, не спричинюючи суттєвих змін осмотичного тиску.
Розчини з однаковим осмотичний тиском називають ізотонічними. Якщо осмотичний тиск одного розчину більший, ніж іншого, то перший розчин с гіпертонічним, а коли навпаки - то гіпотонічним.
Ізотонічність - це одна із вимог, що ставляться до інфузійних розчинів, очних крапель та ін. У клінічній практиці ізотонічними є розчини, осмотичний тиск яких дорівнює осмотичному тиску плазми крові, тобто 7,7-8,1 атм. Це розчини з масовою часткою натрій хлориду 0,85-0,9 % або глюкози - 4,5-5,0 %. Крім того, використовують різні багатокомпонентні фізіологічні розчини, зокрема Рінгера, Рінгера - Локка, Тироде та ін., які за своїм хімічним складом наближаються до плазми крові (містять йони Натрію, Калію, Кальцію, Магнію, Хлору, гідрогенкарбонат-іони, дигідрогенфосфат-іони, глюкозу). Такі розчини можна вводити внутрішньовенно у досить великих кількостях при втратах крові і плазми. Цікаво, що їх склад подібний до складу морської води.
Зміна осмотичного тиску рідини, що оточує клітину, призводить до порушення в ній водного обміну. У гіпотонічних розчинах спостерігається явище лізису, тобто клітини набрякають і руйнуються. Наприклад, якщо еритроцити вмістити в розчин з меншим осмотичним тиском, ніж всередині еритроцита, то вода проникатиме всередину еритроцита і останній набрякає, збільшується в об'ємі і руйнується. Явище руйнування оболонки еритроцитів при введенні у плазму крові гіпотонічних розчинів, що супроводжується виходом гемоглобіну в плазму, називають гемолізом (утворюється "лакова" кров) (див. рис. 2).
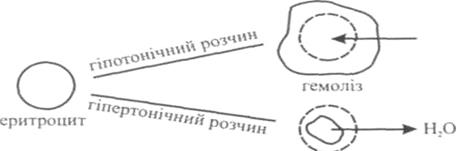
Н2О
плазмоліз
Рис. 2. Гемоліз і плазмоліз еритроцитів
Якщо еритроцити вмістити у розчин з більшим осмотичним тиском, ніж всередині еритроцитів, тобто у гіпертонічний розчин, то вони втрачають воду, різко зменшуються в об'ємі і зморщуються. Явище зморщування еритроцитів при введенні у плазму крові гіпертонічних розчинів називають плазмолізом.
Щоб не порушити осмотичної рівноваги крові, гіпертонічні розчини глюкози (з масовою часткою 20 %, 40 %) вводять у кров внутрішньовенно і дуже повільно, найчастіше крапельним шляхом.
Гіпертонічний розчин натрій хлориду (5-10%) застосовують у хірургії зовнішньо для очищення гнійних ран. При накладанні марлевих пов'язок, змочених таким розчином, рідина із рани рухається у напрямку розчину з більшим осмотичним тиском і це сприяє очищенню її від гною, мікроорганізмів тощо. Гіпертонічні розчини гіркої солі МgSО4 · 7 H2O, або глауберової солі Na2SО4 · 10H2O застосовують як послаблюючі засоби, тому що внаслідок осмосу відбувається перехід великої кількості води із слизової оболонки у просвіт кишок.
Методичні рекомендації
1.При вивченні першого питання скласти опорний конспект.
2.При вивченні другого питання розглянути процес осмосу за малюнком 1, записати математичний вираз закону осмотичного тиску Вант – Гоффа. Скористатися пам’яткою №2. Записати визначення онкотичного тиску та тургору.
3.Розглядаючи третє питання, з’ясувати, які процеси відбуваються при введенні в кров гіпо- та гіпертонічних розчинів.
Запитання для самоперевірки:
1. Яке явище називають осмосом? Що таке осмотичний тиск? Сформулювати закон Вант – Гоффа і написати його математичний вираз для розведених розчинів електролітів і неелектролітів.
2. Що таке онкотичний тиск?
3. Які розчини називають: а) ізотонічними; б) гіпотонічними; в) гіпертонічними? Навести приклади ізотонічних та гіпертонічних розчинів, які використовуються в медичній практиці. У якому з цих розчинів відбувається гемоліз, а в якому – плазмоліз еритроцитів?
Тести для самоконтролю
1. Які з перегородок є напівпроникними:
а) скляна пластинка; б) стінка сечового міхура; в) целофанова плівка.
2. Осмотичний тиск позначається літерою:
а)р; б)  ; в)
; в) 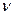 ; г) R.
; г) R.
3. Онкотичний тиск зумовлений наявністю:
а)біополімерів: б) катіонами K+ i Na+; в) аніонами Cl- i SO42-.
|
|
Дата добавления: 2015-05-23; Просмотров: 2080; Нарушение авторских прав?; Мы поможем в написании вашей работы!