
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні рекомендації
|
|
|
|
А б в
Рис.20. Форма окремих ланок молекули білка за різних значень рН розчину:
а - катіонна форма; б- ізоелектричний стан; в - аніонна форма
У лужному середовищі, навпаки, зменшується йонізація аміногруп, молекула білка веде себе як кислота і набуває негативного заряду (20, в):
 Н3N - R -COO- + OH - H2N -- R --COO- +H2O
Н3N - R -COO- + OH - H2N -- R --COO- +H2O
Заряд білка залежить від співвідношення в його молекулах карбоксильних та амінних груп, а також від рН середовища. Якщо при йонізації на поверхні білка виникає однакова кількість позитивних і негативних зарядів, тобто сума електричних зарядів дорівнює нулю (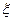 = 0), то такий стан білка називають ізоелектричним (ІЕС). Значення рН розчину, при якому білок знаходиться в ізоелектричному стані, називають ізоелектричною точкою (рНІЕТ). При цьому значенні рН протилежно заряджені групи –NH3+ і –СОО- притягуються одна до одної, молекула закручується у спіраль і згортається у клубок (рис.20, б). У зарядженому стані ланцюги білків мають витягнуту форму (рис. 20, а і в) за рахунок відштовхування однойменно заряджених груп.
= 0), то такий стан білка називають ізоелектричним (ІЕС). Значення рН розчину, при якому білок знаходиться в ізоелектричному стані, називають ізоелектричною точкою (рНІЕТ). При цьому значенні рН протилежно заряджені групи –NH3+ і –СОО- притягуються одна до одної, молекула закручується у спіраль і згортається у клубок (рис.20, б). У зарядженому стані ланцюги білків мають витягнуту форму (рис. 20, а і в) за рахунок відштовхування однойменно заряджених груп.
В ізоелектричній точці набрякання мінімальне, оскільки ступінь гідратації йоногенних груп найменша. Зміна рН в кислу або лужну ділянку відносно ізоелектричної точки призводить до зростання ступеня набрякання (рис.21). Це пояснюється тим, що поява електричного заряду посилює ступінь гідратації макромолекул, а також збільшує сили електростатичного відштовхування між ними.
Саме різким зменшенням рН і набряканням тканини за рахунок сусідніх ділянок пояснюють виникнення набряків при укусах комарів, бджіл, мурашок
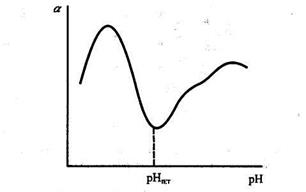
Рис. 21. Вплив рН на ступінь набрякання білків
В ІЕТ не відбувається переміщення молекул під дією зовнішнього електричного поля, спостерігається мінімальна в’язкість розчинів, максимальне світлорозсіяння та набухання, найбільший осмотичний тиск.
У кислому середовищі (відносно ізоелектричної точки)
значення ІЕТ білків залежить від співвідношення в їх молекулах залишків моноамінодикарбонових і діаміномонокарбонових кислот. Більшість природних білків містять значні кількості залишків дикарбонових амінокислот (глутамінової, аспарагінової) і тому належать до кислих білків, тобто їх ІЕТ лежить у кислій ділянці шкали рН. Невелика група основних білків, у молекулах яких переважають вільні групи –NH2 за рахунок підвищеного вмісту залишків діамінових амінокислот (лізину, аргініну, орнітину та ін.), мають ІЕТ у слабколужному середовищі (табл.6.).
Ізоелектрична точка деяких білків
Таблиця 6.
| Білок | рНIEТ | Білок | рНIET |
| Еритроцити крові | 1,70 | Міозин м'язів | 5,00 |
| Пепсин шлункового соку | 2,00 |  -Глобулін крові -Глобулін крові
| 5,20 |
| Казеїн молока | 4,60 | Фібриноген крові | 5,40 |
| Альбумін сироватки крові | 4,64 |  -Глобулін крові -Глобулін крові
| 6,40 |
| Білки плазми крові | 4,70 | Гемоглобін крові | 6,80 |
| Желатина | 4,70 | Гістон клітинних ядер | 8,50 |
| Альбумін яйця | 4,71 | Хімотрипсин соку | |
| підшлункової залози | 8,60 | ||
| а-Глобулін крові | 4,80 | Гліадин пшениці | 9,80 |
Як було зазначено вище, розчини ВМС утворюються самочинно, і є термодинамічно стійкими і оборотними системами. їх стійкість визначається розчинністю полімеру в даному розчиннику. Зокрема, термодинамічна стійкість біополімерів пов'язана з їх великою гідрофільністю і адсорбцією молекул води. Порушити стійкість розчинів полімерів може будь-який чинник, який погіршує розчинність ВМС у даному розчиннику. Зміну розчинності ВМС можна здійснити такими чинниками: 1) зниженням температури; 2) додаванням розчинника, в якому полімер важко розчиняється; 3) уведенням електролітів.
При додаванні електролітів спостерігається перетворення гомогенного розчину ВМС у гетерогенну систему. Процес осадження ВМС принципово відрізняється від коагуляції золів електролітами. Коагуляцію колоїдних розчинів спричинює відносно невелика кількість електроліту і цей процес є необоротним. Виділення ВМС із розчину відбувається при додаванні концентрованого розчину електроліту і пояснюється зменшенням розчинності полімеру внаслідок усунення сольватної оболонки, яка оточує його макромолекули. Процес є оборотним: після видалення електроліту з осаду (промиванням або діалізом) полімер знову може розчинитись. Явище оборотного осадження ВМС під дією концентрованих розчинів електролітів називають висолюванням.
При осадженні ВМС із розчинів електролітами вирішальне значення має не заряд йона-коагулятора (як при коагуляції золів), а схильність його до гідратації. Між макромолекулами ВМС і йонами електроліту відбувається конкурентна "боротьба" за диполі води.
Вирішальне значення у висолюванні, як і в набряканні, належить аніонам. Висолювальна дія аніонів відображається ліотропним рядом Гофмейстера:
С2О42- > SО42-> F-> СгО42-> СН3СОО-> С1-> NO3-> Вг- > І- > SСN-
У такий самий ряд, але з меншим висолювальним ефектом, розміщуються і катіони:
Li+ > Na+ > К+ > RЬ+ > Сs+ Мg2+ > Са2+ > Sг2+ > Ва2+
Йони електролітів, які найсильніше гідратуються (перші члени ліотропних рядів), виявляють підвищену висолювальну дію. За однакової величини заряду краще гідратуються ті йони, у яких менший радіус. Тому для висолювання білків використовують концентровані розчини сульфатів амонію, натрію, магнію, а також сухий натрій хлорид та ін. Осадити білки можна також додаванням дегідратуючих речовин, зокрема етанолу, ацетону.
Висолювання білків концентрованими розчинами солей є одним із методів фракціонування білкових сумішей на основі різної молекулярної маси компонентів: спочатку осідають білки з великою молекулярною масою (глобуліни), а потім - з меншою (альбуміни). Зниження розчинності білків можна досягти додаванням етанолу, солей і охолодженням. На цьому ґрунтуються методи детального фракціонування білкових сумішей за Коном. Наприклад, із сироватки крові за допомогою цього методу вилучено понад десять білків.
Висолювання білків слід проводити за значень рН середовища, близьких до ізоелектричної точки. За інших значень рН зростає заряд і гідратація білкових молекул, що посилює розчинність.
Специфічне незворотне осадження білків, при якому змінюється їх структура і властивості, називають денатурацією. Денатурація відбувається під впливом різкої зміни температури, дії висококонцентрованих розчинів кислот або лугів, ультразвуку, високого тиску, променевої енергії тощо. При цьому за рахунок руйнування водневих зв'язків і сольових містків порушується просторова форма і орієнтація білкової молекули (вторинна і третинна структура). Це призводить до втрати біологічної активності білків. Прикладом денатурації є варіння курячого яйця, приготування іншої гарячої їжі.
Сильне нагрівання може спричинити не тільки денатурацію білків, але й їх розкладання з виділенням летких продуктів.
У розчинах ВМС за зміни температури, рН або при додаванні низькомолекулярних речовин іноді спостерігається явище коацервації - своєрідної форми коагуляції розчинів ВМС. Коацервація відрізняється від висолювання тим, що речовина дисперсної фази не відділяється від розчинника, а відбувається злиття гідратних оболонок кількох частинок у краплини більших розмірів. Цей процес закінчується розшаруванням системи на два рідкі шари: розчин ВМС у розчиннику і розчин розчинника у ВМС. Шар, що вміщує всю або майже всю високомолекулярну сполуку, називають коацерватом.
Коацервація відіграє важливу роль у біологічних процесах, що відбуваються у клітинній речовині - протоплазмі, оскільки коацервати за деякими фізико-хімічними властивостями нагадують протоплазму.
За певних умов розчини ВМС втрачають свою текучість, перетворюючись в однофазні структуровані системи ВМС і розчинника - драглі. Вони можуть утворюватись у двох випадках.
1. Із розчину полімеру при його охолодженні, концентруванні, при додаванні невеликих кількостей електролітів, при зміні рН середовища.
2. При обмеженому набряканні полімеру у низькомолекулярному розчиннику:
 Розчин ВМС Драглі ВМС
Розчин ВМС Драглі ВМС
охолодження, обмежене
концентрування набрякання
Процес утворення драглів із розчинів ВМС називають драглюванням. Причиною драглювання є виникнення і зміцнення зв'язків між макромолекулами ВМС з утворенням просторової сітки (каркасу), яка утримує у проміжках весь об'єм (до 99 % загальної маси) розчинника. В результаті система втрачає текучість і набуває властивостей твердого тіла.
На швидкість драглювання розчинів полімерів впливає температура і рН середовища. Підвищення температури перешкоджає драглюванню в результаті збільшення інтенсивності броунівського руху молекул і зменшення числа та тривалості існування зв'язків між макромолекулами. Драглювання білків максимальне за значень рН, близьких до ізоелектричної точки, коли полімер існує в ізоелектричному стані.
Для драглів характерні такі властивості.
1. Оборотна деформація (еластичність) - здатність драглів до певної межі оборотно змінювати форму під дією прикладеної сили.
2. Тиксотропія - оборотне ізотермічне руйнування структури (при струшуванні, перемішуванні) та її відновлення після припинення механічної дії. Таким чином, тиксотропію можна розглядати як оборотний процес: драглі 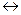 розчин ВМС. Наприклад, протоплазма лімфоцитів розріджується внаслідок зовнішньої дії, але потім швидко відновлює
розчин ВМС. Наприклад, протоплазма лімфоцитів розріджується внаслідок зовнішньої дії, але потім швидко відновлює
свою структуру.
3. Синерезис - явище ущільнення драглів, що супроводжується зменшенням їх об'єму (із збереженням форми) за рахунок додаткового зміцнення зв'язків між макромолекулами і відокремлення рідкої фази (розчину полімеру меншої концентрації). Синерезис відбувається у драглях тоді, коли система ще не досягла стану рівноваги і в ній продовжуються процеси структурування. Він спостерігається при зберіганні драглів.
Саме з явищем синерезису і дегідратацією пов'язують жилавість і жорсткість м'яса старих тварин, виникнення патологічних пухлин в організмі, зменшення еластичності тканин людини з віком
1. При вивченні першого питання скласти опорний конспект. Ознайомитися з таблицею, яка ілюструє використання синтетичних полімерів у медичній практиці.
2. При опрацюванні другого питання розглянути процес набрякання та чинники, які його зумовлюють.
3. При вивченні третього питання звернути увагу на процес висолювання ВМС та властивості драглів
4. При опрацюванні четвертого питання розглянути процес коацервації та її біологічну роль.
5. При розгляді п’ятого питання скласти опорний конспект.
Запитання для самоперевірки:
1. Які сполуки належать до високомолекулярних? Яка їх будова?
2. Які функції виконують біополімери в організмі?
3. Які особливості процесу розчинення полімерів і з яких стадій він складається?
4. Охарактеризуйте явище набрякання ВМС. Опишіть методику визначення ступеня набрякання. Які чинники впливають на набрякання полімерів?
5. Охарактеризувати ізоелектричний стан та ізоелектричну точку поліелектролітів (білків).
6. Які зміни відбуваються при: а) висолюванні білка; б) денатурації білка?
7. Чим коацервація відрізняється від висолювання?
8. Що таке тиксотропія і синерезис драглів?
9. Охарактеризуйте ізоелектричний стан та ізоелектричну точку поліелектролітів (білків).
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 3264; Нарушение авторских прав?; Мы поможем в написании вашей работы!