
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Й закон Коновалова
|
|
|
|
Й закон Коновалова
Насичена пара бінарної суміші завжди буде збагачена, тим компонентом, додавання якого до рідкої фази буде збільшувати тиск насиченої пари, або знижувати температуру кипіння розчину.
Насичена пара бінарної суміші завжди буде збагачена більш летким компонентом.
Залежність температури кипіння від складу.
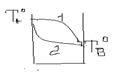
1 –пара 2 –рідина
2 –й закон Коновалова стосується розчинів, які характеризуються відхиленням від з-ну Рауля.
- При додатному відхиленні від з-ну Рауля.

1 – max
2 – рідина; 3 – пара; 4 –пара + рідина;
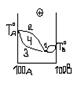
1 – min
2 –пара; 3 – рідина; 4 – пара + рідина;
- При негативному відхиленні від закону Рауля.

1 – max
2 –пара; 3 – рідина; 4 – пара + рідина

1 - min 2 – рідина; 3 – пара; 4 –пара + рідина
В точках екстремуму[ ( max та min) залежностей тиску нас. пари, та (max та min) залежностей температури кипіння від складу] склад пари і рідкої фази є однаковим.
Суміші які відповідають екстрим. точкам назив. азеотропними. Це означає, що жодним фізико – хімічним методом, в тому числі і шляхом перегонки, неможливо розділити компоненти між собою. Н: 20,2% НСІ 68% Н NО3
Розділення сумішей шляхом перегонки.
Явище різного складу пароподібної та рідкої фаз лежить в основі теорії перегонки.
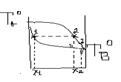
Рідина зникає тоді, коли тиск її насиченої пари буде = зовнішньому атмосферному тиску.
Нагріваючи рідкий розчин вмістом Х1 (1), ми перетворюємо його у пароподібну фазу в наслідок кипіння до т. (2), сконденсувавши її до т. (3) ми одержуємо рідку фазу збагачену більш летким компонентом Х2. Почергово здійснюючи багаторазово процеси випаровування та конденсації в кінцевому результаті ми отримуємо леткий компонент В а у вихідній колбі важко леткий компонент А.
Ф.Х.
10. ЕБУЛІОСКОПІЯ
Рідина закипає тоді коли тиск її насиченої пари = зовнішньому атмосферному тиску.
Залежність тиску насиченої пари від температури має вигл.

1 – залежність тиску насиченої пари чистого розчинника від температури.
2 – зал. Тиску насиченої пари над розчином від температури.
Т кипіння р-ну − Т кип. 0 = ∆ Т кип. – підвищення темп.кип. р-ну.
∆ Т кип залежить від:
1) Від концентрації розчину – прямо пропорційно.
2) Від природи розчинника.
3) Не залежить від природи розчиненої речовини.
Така властивість величина якої не залежить від природи розчиненої речовини, а залежить від кількості її частинок називається колігативною.(∆ Т кип., ∆ Тзамерзання, зниження тиску насиченої пари над розчином, осмотичний тиск розчинів).
Щоб порівняти вплив природи розчинника на температуру кипіння розчину вводять поняття ебуліоскопічної сталої Е.
Ебуліоскопічна стала Е. – це величина, яка показує на скільки підвищується Т кип. Чистого розчинника, якщо в 1000г його розчинити 1 моль будь – якого неелектроліту
Для теоретичного розрахунку величини підвищення Т кип. Вант – Гоф вивів форм. ∆ Т кип = RT02 кип/1000L *m
m – моляльність розчину
RT0 кип – температура кипіння чистого розчинника
L – питома прихована теплота випаровування.
L = λ ⁄ m
λ – мольна прихована теплота випар.
Якщо m = 1, то ∆ Т кип = RT02 кип/1000L = Е – фізичн. Зміст ебуліоскопічної сталої, тобто це є таке підвищення
Т кип р-ну коли моляльність = 1.
∆ Т кип = Е * m
Група методів дослідження фізико - хімічних властивостей на основі вимірювання Т кип. Розчину назив. Ебуліоскопією( ебуліо від лат – кипить)
М = 1000 * g * Е / G * ∆Ткип
- ф-ла для знах молекулярної маси розчиненої речовини.
і = 1 + α (ν – 1) – ф-ла для теоретичного розрахунку вел. Ізотонічного коеф.
α – ступінь дисоціації електроліту.
(ν – сумарна кількість іонів, що утворюються в результаті дисоціації однієї молекули електроліту.
∆ Т кип (експерем) >∆ Т кип(теоретик)
∆ Т кип (експерем) ⁄ ∆ Т кип(теоретик) = і
Для розчинів сильних електролітів використовуються фсі попередні ф-ли із врахуванням ізотонічного коефіцієнту.
- ∆ Т кип = RT02 кип/1000L *m * і
- ∆ Т кип = Е * m * і
Величину ебуліоскопічної сталої беруть із довідника.
- М = 1000 * g * Е / G * ∆Ткип} * і
Ф.Х.
11. КРІОСКОПІЯ
«Кріо» - замерзання
Рідина замерзає тоді коли тиск її насиченої пари = тиску насиченої пари над утвореною твердою фазою.
Залежність тиску насиченої пари від температури має вигл.
 1 – залежність тиску насиченої пари над рідким розчинником.
1 – залежність тиску насиченої пари над рідким розчинником.
2 – зал. Тиску насиченої пари над рідким розчином
3 – зал. Тиску насиченої пари над твердою фазою.
Отже розчини замерзають при нижчих температурах ніж чистий розчинник.
Т замер 0. − Т замер р-ну = ∆ Т замерзання – зниження темп.замерзання. р-ну.
∆ Т замер. залежить від:
А)Від концентрації розчину – прямопропорційно.
В)Від природи розчинника.
Б)Не залежить від природи розчиненої речовини.
Щоб порівняти вплив природи розчинника на температуру замерзання розчину вводять поняття кріоскопічної сталої К.
Кріоскопічна стала К. – це величина, яка показує на скільки знижується Т зам.. чистого розчинника, якщо в 1000г його розчинити 1 моль будь – якого неелектроліту
Для теоретичного розрахунку величини Т зам. Вант – Гоф вивів форм. ∆ Т зам = RT02 зам/1000L *m -фізичний зміст кріоскопічної сталої
m – моляльність розчину
RT0 кип – температура кипіння чистого розчинника
L – питома прихована теплота випаровування.
L = λ ⁄ m
λ – мольна прихована теплота пл..
Якщо m = 1, то ∆ Т кип = RT02 кип/1000L = К.
∆ Т зам = Е * m
Група методів дослідження фізико - хімічних властивостей на основі вимірювання Т зам. Розчину назив. Кріоскопією
М = 1000 * g * К / G * ∆Тзам
- ф-ла для знах молекулярної маси розчиненої речовини.
і = 1 + α (ν – 1) – ф-ла для теоретичного розрахунку вел. Ізотонічного коеф.
α – ступінь дисоціації електроліту.
(ν – сумарна кількість іонів, що утворюються в результаті дисоціації однієї молекули електроліту.
∆ Т зам(експерем) >∆ Т зам(теоретик)
∆ Т зам (експерем) ⁄ ∆ Т зам(теоретик) = і
Для розчинів сильних електролітів використовуються фсі попередні ф-ли із врахуванням ізотонічного коефіцієнту.
- ∆ Т зам = RT02 кип/1000L *m * і
- ∆ Т зам = Е * m * і
Величину ебуліоскопічної сталої беруть із довідника.
- М = 1000 * g * Е / G * ∆ Т зам} * і
Кріоскопічні методи характеризуються більшою точністю вимірювань і тому викор. частіше.
Ф.Х.
12. ЯВИЩЕ ОСМОСУ. ОСМОТИЧНИЙ ТИСК. БІОЛОГІЧНА РОЛЬ.
Явище осмосу виникає тоді коли розчин межує або з чистим розчинником, або з р-ном іншої концентрації.
Осмос – це явище самовільної, односторонньої,дифузії молекул розчинника через на пів проникливу перегородку в р-н більшої концентрації.
А) Б)

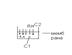
В якості мембрани можуть використовуватися целофан, інші полімери, пергамент, шкіра.
Роль мембрани.
За рахунок наявних отворів у мембрані відбувається переміщення молекул розчинника з розмірами меншими, або спів розмірними отворам.
Осмотичний тиск Р осм. – це тиск який створюють молекули розчинника, в наслідок осмосу на одиницю поверхні мембрани.
Величину осм. тиску вимірюють за допомогою приладів осмометрів.
Експериментально величину Р ос. вимір. як гідростатичний тиск, який необхідно прикласти на зустріч осмосу, щоб повністю припинити його.
Для теоретичних розрахунків Р ос викор з-н Вант- Гофа
О смотичний тиск р-ну неелектроліту буде = тому газовому тиску, який би створила розчинена речовина якби вона у вигляді газу займала той самий об’єм який займає розчин.
Так як Вант- Гоф прирівняв р-н до газу, то застосувавши р-ня Мін діл –Клапейрона для ідеальних газів:
РV = nRT
P = n/V * RT - для газів
P осм = CM * RT - для розчинів
Длля розчинів електролітів P осм = і * CM * RT
Біологічне значення осмосу.
Якщо клітину помістити в р-н меншої концентрації ніж концентрація внутрішньоклітинного р-ну, то починає самовільно виникати явище осмосу, тобто проникнення молекул розчинника із зовнішнього розчину в середину клітини. При цьому клітина набухає і більш щільно прилягає до целюлозних стінок клітини. Явище набухання назив тургором, а явище проникнення молекул розчинника в середину клітини – ендосмосом.
- Як що клітину помістити в р-н більшої концентрації то виникатиме явище осмосу зумовлене проникненням молекул розчинника зсередини клітини у зовнішній р-н – екзоосмос.
Клітина ж при цьому зморщується та зсихається, якщо процес триває довго. Це явище називають плазмолізом.
Для високоорганізованих тварин і людини Р осм. = 8 атм.
-Розчини які мають однакове значення Р осм. – назив Ізотонічними. До них належать фізіологічні р-ни (глюкоза)
-Р-н який має більший осмотичний тиск ніж даний назив – Гіпертонічним.
-Р-н який має менший Р осм. ніж даний назив Гіпотонічним
Ізотонічні р-ни викор в медицині, (вводяться внутрішньовенно).
Гіпертонічні р-ни викор тільки у вигляді зовнішніх марлевих повязок при лікуванні гангрени або гнійних ран.
Ф.Х.
1. АГРЕГАТНІ СТАНИ РЕЧОВИН. ІДЕАЛЬНІ ТА РЕАЛЬНІ ГАЗИ. ОСНОВНІ ЗАКОНИ ІДЕАЛЬНИХ ГАЗІВ.
Більшість речовин залежно від умов можуть існувати в різних агрегатних станах. Проте для деяких речовин неможливо одержати за жодних умов певного агрегатного стану. Н: СаСО3 - неможливо досягти рідкого та газоподібного стану бо в процесі нагрівання він руйнується.
СаСО3 = СаО + СО2
Але в той же час деякі речовини можуть одночасно співіснувати в декількох агрегатних станах.
Н: Р, Н2О,S.
Перехід речовини з рідкого стану в газоподібний – випаровування. Зворотній до нього процес – конденсація.
Перехід речовини з твердого в рідкий – плавлення.
Зворотній - затвердівання.
Сублімаціч – перехід з твердого стану в газоподібний, а зворотній десублімація(конденсація).
Поліморфне перетворення – це перехід з однієї модифікації речовини в іншу, при одному і тому ж агрегатному стані.
1) Газоподібний стан – хар. дуже слабою взаємодією між молекулами в наслідок чого газ завжди займає весь наданий йому об’єм. Тому він легко змінює форму і об’єм.
2) Рідкий стан – хар. порівняно більшими міжмолекулярними силами, тому молекули втрачають здатність рухатись незалежно одна від одної і віддалятись на значну відстань, в результаті рідина легко змінює форму і практично не змінює свого об’єму.
3) Твердий стан – хар. впорядкованим розташуванням молекул, атомів або іонів з утворенням кристалічної гратки. Хар. великими силами міжмолекулярної взаємодії і тому не можливо змінити ні форму ні об’єм твердого тіла не зруйнувавши його.
4) Плазма – це суміш іонів, радикалів та електронів, оголених ядер і продуктів їх розкладу. В стан плазми газ може переходити під впливом різних факторів: а) при високих температурах(сотні тисяч); б) під впливом електричного розряду; в) під впливом рентгенівського опромінення; …
Ступінь іонізації плазми хар. величиною α З алежно від ступеня іонізації розрізняють наступні види плазми:
- якщо α < 1% слабо іонізована;
- якщо α < 1%< 10% помірно іонізована;
- якщо α = 100% повністю іонізована.
Наявність у плазмі позитивно заряджених іонів та електронів зумовлює її високу електропровідність.
Плазма – це газ, що світиться. Явище світіння зумовлене енергетичними переходами електрона з одного рівня на інший.
Технічне використання плазми зумовлене можливістю керованої її енергії(«Керована термоядерна реакція» -Сахаров).
Основні закони ідеального газу.
Ідеальний газ – це гранично розріджений стан газу для якого хар. 3 ознаки. А) між молекулами не існує сил взаємодії.
Б) Молекули не мають власного об’єму, тобто розмірами їх можна знехтувати і розглядати, як математ. точки.
В)молекули рухаються хаотично.
Стан газоподібного тіла, як і будь - який інший агрегатний стан хар. 3 – ма основними параметрами: Р, V, t.
1. з-н Бойля – Маріотта
Для даної маси ідеального газу при сталій температурі добуток тиску на обєм є величина стала.
Р * V = const
Р 1* V1 = Р2 * V2
Р = f (V)
Д ля даної маси ідеального газу при сталій температурі, об’єми даної кількості ідеального газу обернено пропорційні зовнішньому тиску під яким вони знаходяться. V1 /V2 = P2 /P 1 ; P 1 /P2 = V2/V1
Графічна залежність ізотермічного процесу назив. ізотермою і має вигляд гіперболи.

Т1 < Т2 < Т3
Для даної маси І. Г. при сталій температурі величина густини та концентрації газу будуть прямо пропорційні їх відповідним тискам.; P 1 /P2 = ρ1/ρ2;; P 1 /P2 = С1/С2.
2. Гей – Лисака.
Характеризує ізобарний процес. Р = const V= f (t)
Для даної маси ідеального газу при сталому Р, зміна температури на 1° С призводить до зміни на 1⁄ 273,16 його початкового об’єму виміряного при 0° С.
V t = V0 (1 + 1/273, 16 * t)
Якщо 1/273, 16 = α тоді V t = V0 (1 + α * t)
Графічна залежність називається ізобарою і є лінійною.

Р1> Р2> Р3
При переході до абсолютних температур з-н набуває іншого формулювання.
Для даної маси ідеального газу при сталому Р, об’єми прямо пропорційні їх абсолютним температурам.
V1 /V2 = Т1/Т2;
Р1 > Р2 >Р3
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 425; Нарушение авторских прав?; Мы поможем в написании вашей работы!