
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1.5. Хімічна рівновага
|
|
|
|
Тема 1.4. Термодинамічні потенціали
Тема 1.3. Застосування другого закону термодинаміки до фізико-хімічних процесiв
Самочинні та несамочинні процеси. Інтенсивні та екстенсивні властивості. Формулювання та аналітичний вираз другого закону термодинаміки. Ентропія. Зміна ентропії як критерій напрямку самочинних процесiв та стану рівноваги в ізольованих системах. Зміна ентропії в фізичних процесах: при нагріванні речовини, при фазових перетвореннях, в різних процесах за участю ідеальних газів.
Постулат Планка. Залежність ентропії від температури. Абсолютна та стандартна ентропії. Зміна ентропії в ізотермічному хімічному процесi. Ентропія утворення хімічної сполуки. Розрахунок зміни ентропії внаслідок хімічної реакції за певної температури.
Статистичний характер другого закону термодинаміки. Зв’язок мiж ентропією системи та її термодинамічною імовірністю.
Енергії Гіббса та Гельмгольца, зв’язок між ними. Максимальна корисна робота ізохорного та ізобарного процесів. Критерії напрямку самочинних процесiв та рівноваги в закритих системах. Характеристичні функції. Зв'язок між ними. Температурні залежності енергії Гіббса та енергії Гельмгольца. Зв’язок ізобарно-ізотермічного та ізохорно-ізотермічного потенціалів з тепловим ефектом та зміною ентропії. Рівняння Гіббса-Гельмгольца. Стандартний потенціал утворення хімічної сполуки, його зв’язок з хімічними властивостями сполук.
Розрахунки зміни енергії Гіббса в хімічній реакції за допомогою таблиць термодинамічних величин. Визначення напрямку перебігу процесу.
Розрахунки зміни енергії Гіббса в хімічному процесi за різних температур.
Хімічний потенціал. Зв’язок хімічного потенціалу ідеального газу з його тиском. Хімічний потенціал реального газу. Фугітивність та коефіцієнт фугітивності.
Хімічно оборотні та хімічно необоротні реакції. Ознаки та властивості хімічної рівноваги. Зміна стану рівноваги як один з найважливіших чинників керування хімічним процесом.
Закон діючих мас. Кінетичне та термодинамічне обґрунтування закону діючих мас для стану рівноваги. Константа рівноваги та способи її вираження для газофазних ідеальних систем (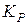 ,
, 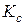 ,
, 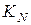 ). Зв’язок мiж
). Зв’язок мiж 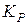 ,
, 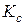 ,
, 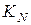 . Залежність величини та розмірності константи рівноваги від форми запису рівняння хімічної реакції. Хімічна рівновага в гетерогенних системах.
. Залежність величини та розмірності константи рівноваги від форми запису рівняння хімічної реакції. Хімічна рівновага в гетерогенних системах.
Рівняння ізотерми хімічної реакції. Хімічна спорідненість. Вплив вихідного складу системи на напрямок самочинного процесу. Розрахунок константи рівноваги за рівнянням стандартної ізотерми.
Залежність положення рівноваги від зміни зовнішніх умов. Принцип рухомої рівноваги Ле Шательє – Брауна. Вплив тиску, температури, зміни концентрації компонентів, додавання інертного газу на стан рівноваги.
Залежність константи рівноваги від температури, рівняння ізобари та ізохори хімічної реакції. Методи теоретичного розрахунку констант рівноваги з використанням таблиць термодинамічних величин. Наближені та точні розрахунки за рівнянням ізобари, за величиною 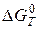 , за методом Тьомкіна–Шварцмана. Визначення
, за методом Тьомкіна–Шварцмана. Визначення 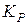 за допомогою метода комбінування рівноваг, за логарифмами констант рівноваги реакцій утворення учасникiв процесу. Вибір оптимальних умов проведення хімічного процесу.
за допомогою метода комбінування рівноваг, за логарифмами констант рівноваги реакцій утворення учасникiв процесу. Вибір оптимальних умов проведення хімічного процесу.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 751; Нарушение авторских прав?; Мы поможем в написании вашей работы!