
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Наслідки закону Авогадро
|
|
|
|
1. Молярний об’єм будь-якого газу за нормальних умов дорів-нює 0,0224 м3моль-1, або 22,4 л моль-1. Нормальні умови: тиск р = 101325 Па, Т = 273,15 К, або t = 00 С.
Відомо, що різні речовини, взяті кількістю 1 моль, містять однакове число структурних елементів цієї речовини (молекул, йонних асоціатів тощо).
З закону Авогадро випливає, що однакове число молекул газів за однакових умов займає однаковий об’єм.
Отже, гази, взяті за однакових умов в кількості 1 моль, займають однаковий об’єм.
Обчислимо об’єм 1 моль газу за нормальних умов. Для цього скористаємося формулою V = m: ρ, де V - об’єм, m - маса, ρ - густина газу. Коли n = 1 моль, m = M, де M - молярна маса, V = VМ, де VМ - молярний об’єм. Формула перетвориться на VМ = M: ρ.
Маса 1 л кисню за нормальних умов дорівнює 1,43 г. Отже, об’єм, що займає 1 моль кисню за нормальних умов, буде:
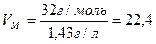 л/моль.
л/моль.
Те саме число одержимо для об’єму 1 моль будь-якого газу.
2. Маси однакових об’ємів двох газів відносяться одна до одної, як їхні молекулярні маси, або як чисельно рівні їм молярні маси:
 ,
,
де m1 і m2 - маси, Mr1 i Mr2 - молекулярні маси, а M1 і M2 - молярні маси першого і другого газів.
Відношення маси певного газу до маси такого самого об’єму іншого газу, взятих за однакових температурі і тиску, називається відносною густиною першого газу відносно другого.
Наприклад, маса 1 л карбон(IV) оксиду дорівнює 1,98 г, а маса 1 л водню за тих самих умов – 0,09 г, звідки густина СО2 відносно водню дорівнює:
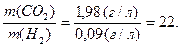
Позначимо відносну густину газу  буквою D. Тоді
буквою D. Тоді  , звідки M1 = D . M2.
, звідки M1 = D . M2.
Молярна маса газу дорівнює його густині відносно іншого газу, помноженій на молярну масу цього газу.
Найчастіше густини різних газів визначають відносно водню або повітря. Оскільки молярна маса водню дорівнює 2,0158 г/моль (округлено 2 г/моль), то рівняння для обчислення молярної маси має вигляд:
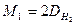 .
.
Повітря є сумішшю кількох газів, але для нього можна визначити середню молярну маси з густини повітря відносно водню. Знайдена таким способом молярна маса повітря Mn дорівнює 29 г/моль.
Позначивши густину досліджуваного газу відносно повітря через Dn, одержимо таке рівняння для обчислення молярних мас:
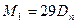 .
.
З одержаних рівнянь можна визначити відносну густину газів:
 .
.
Відносна густина газу дорівнює відношенню молярної або відносної молекулярної маси газу до молярної або відносної молекулярної маси іншого газу, який взято за зразок.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3413; Нарушение авторских прав?; Мы поможем в написании вашей работы!