
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Завдання для самостійного розв’язування
|
|
|
|
Солі
Солі – це речовини, які при дисоціації утворюють йони основних і кислотних залишків.
Солі поділяють на середні (нормальні), кислі та основні.
В результаті повної взаємної нейтралізації кислоти і основи утворюються нормальні солі:

натрій хлорид

натрій сульфат
Назви нормальних солей утворюються з назв катіонів з зазначенням ступеня окиснення (у випадку змінного) і назв аніонів або з застосуванням відповідних множних префіксів. Наприклад, Сr2(SO4)3 – хром(ІІІ) сульфат або дихромтрисульфат.
При частковій нейтралізації багатоосновної кислоти утворюються кислі солі:

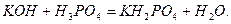
Кислі солі називають так само, як середні, але з додаванням до назви аніона слова „гідроген”, що пишуть разом з відповідним числовим префіксом. Нариклад, NaHSO4 – натрій гідрогенсульфат, КН2РО4 – калій дигідрогенфосфат.
При поступовому додаванні розчину лугу до нормальних солей багатокислотних основ спочатку утворюються малорозчинні основні солі, які при подальшому додаванні лугу перетворюються в відповідні нерозчинні гідроксиди:

алюміній гідроксид хлорид
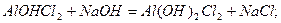
алюміній дигідроксид хлорид
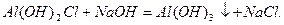
алюміній гідроксид
Солі, до складу яких входять залишки двох основ і однієї кислоти, називають подвійними.
В назві подвійних солей катіони перелічують в алфавітному порядку. Наприклад, KMgCl3 – калій магній трихлорид, NaNH4HPO4 –амоній натрій гідрогенфосфат.
Солі, до складу яких входять залишки двох кислот і однієї основи, називають змішаними. Наприклад, СаОСl2, до складу цієї солі входять кислотні залишки кислот хлоридної НСl та хлоратної(І) НОСl.
Деякі солі зберігають технічні назви: Na2CO3 – сода; К2СО3 – поташ; КNO3 – калійна селітра; NaCl – кам’яна, кухонна сіль; KСlO3 – бертолетова сіль; Na2SO4 . 10 H2O – глауберова сіль; FeSO4 . 7 H2O – залізний купорос; CuSO4 . 5 H2O – мідний купорос тощо.
Багато солей широко використовують в промисловості, сільському господарстві як мінеральні добрива та засоби захисту від шкідників, в меліорації земель, в будівництві, медицині тощо.
Хлориди – KCl, NH4Cl, нітрати – KNO3, NaNO3, Ca(NO3)2, гідроген- та дигідрогенфосфати кальцію – цінні мінеральні добрива. Суміш Са(Н2 РО4)2 та СaSO4 – простий суперфосфат, СaHPO4 . 2H2O – преципітат, Са(Н2РО4)2 – подвійний суперфосфат. Подвійний суперфосфат і преципітат застосовують не тільки як мінеральні добрива. Так, Са(Н2РО4)2 використовують в хлібо-печенні, СаНРО4 . 2Н2О – для годування тварин.
Мідний та залізний купороси застосовують для боротьби з шкідниками сільськогосподарських культур, для консервації деревини.
В будівництві солі використовують як добавки до цементу. Калій карбонат К2СО3, калій сульфат К2SO4, кальцій хлорид СаСl2 прискорюють твердіння цемента; натрій гідрогенфосфат Na2HPO4 – сповільнює; натрій, калій та кальцій нітрити захищають металічну арматуру в залізобетонних конструкціях від корозії; кальцій карбонат СаСО3 підвищує стійкість бетонів проти лугів; солі Кадмію і Плюмбуму підвищують міцність проти бактерій і морозу та радіаційну стійкість. Кальцій карбонат (крейда, мармур), алебастр CaSO4 . 0,5H2O – будівельні матеріали.
Підсумком розглянутої теми може слугувати таблиця 1. (див.додаток).
Запитання для самоконтролю
1. На які основні класи поділяють неорганічні сполуки?
2. Які елементи входять до складу основних оксидів?
3. Які основні оксиди розчиняються у воді і реагують з водою?
4. Чи можуть метали утворювати кислотні оксиди?
5. Як утворюють назви оксидів?
6. Які найбільш характерні хімічні реакції для основних, кислотних та амфотерних оксидів?
7. Які метали утворюють луги при взаємодії з водою?
8. Як називається реакція між лугом і кислотою?
9. Чому амфотерні оксиди та амфотерні гідроксиди мають основні і кислотні властивості?
10. На які дві групи поділяють кислоти за вмістом, чи відсутністю кисню?
11. Як можна одержати кислоту, якщо кислотний оксид, який їй відповідає, не розчиняється у воді?
12. За якою ознакою солі поділяють на середні, кислі і основні?
13. Як можна одержати кислу і основну сіль з середньої?
14. Як утворюють назви середніх, кислих і основних солей?
1. Скласти формули вищих оксидів наступних елементів: Сульфуру, Фосфору, Мангану, Хлору, Натрію, Алюмінію, Нітрогену, Силіцію. Назвати ці оксиди.
2. Вказати хімічний характер оксидів: CuO, CaO, Cl2O, Mn2O7, N2O5, CO, Al2O3, NO, CO2, CrO3, Cr2O3, CrO. Які з цих оксидів можуть реагувати: а) з натрій гідроксидом; б) з сульфатною кислотою? Написати рівняння реакцій.
3. Скласти формули ангідридів наступних кислот: H3PO4, HNO3, HNO2, H2SO4, HMnO4, H2CrO4.
4. Скласти рівняння реакцій одержання: а)алюміній гідроксиду; б) ферум(ІІІ) гідроксиду; в) силікатної кислоти.
5. Закінчити рівняння реакцій та вказати, кислотні чи основні властивості виявляють в них амфотерні гідроксиди:
Cr(OH)3 + NaOH →;
Be(OH)2 + H3PO4 →;
Zn(OH)2 + Ba(OH)2 →;
Al(OH)3 + H2SO4 →.
6. Закінчити рівняння реакцій:
CrCl3 + KOH →;
CrCl3 + KOH (надлишок) →;
ZnCl2 + NaOH →;
ZnCl2 + NaOH (надлишок) →.
7. Скласти формули наступних солей: магній нітрату; кальцій нітриту; кальцій сульфіду; натрій сульфату; калій сульфіту; натрій гідрогенсульфіду; кальцій гідрогенсульфату; магній гідроген- сульфіду; барійгідроген карбонату; купрум(ІІ) гідроксид карбонату; алюміній дигідроксид нітрату.
8. Назвати солі: Ca(HS)2; Na2HPO4; NaH2PO4; Mg(HSO3)2; AlOHSO4; Al2(OH)4SO4; CaOHNO3.
9. Закінчити рівняння реакцій:
Na2S + H2S →; PbSO4 + H2SO4 →;
Na3PO4 + H3PO4 →; NaHCO3 + NaOH →;
AlOHSO4 + H2SO4 →; СаSO4 + H2SO4 →;
CuSO4 + NaOH →; CuSO4 + NaOH→.
надлишок розбавлений
розчин
10. Написати рівняння реакцій, за допомогою яких можна виконати наступні перетворення:
а) Ca→CaO→Ca(OH)2→CaSO4→Ca(HSO4)2→CaSO4;
б) Al→Al2O3→Al2(SO4)3→Al(OH)3→AlOHCl2→AlCl3→Na3AlO3;
в) K→KOH→K2SO4→KHSO4.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 531; Нарушение авторских прав?; Мы поможем в написании вашей работы!