
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 2. Найважливіші класи неорганічних сполук
|
|
|
|
Задачі для самостійного розв’язування
1. Яка кількість речовини молекулярного азоту знаходиться в певному об’ємі, якщо він містить 1,2. 1023 молекул?
2. Яке число молекул міститься в будь-якій газоподібній речовині об’ємом 1 л за нормальних умов?
3. В якій масі СО та СО2 міститься по 1,2. 1024 молекул?
4. Визначити массу молекул О2 та О3.
5. Який об'єм займає метан СН4 масою 64 г при температурі 1100 С і тиску 0,96. 106 Па?
6. Газ массою 1,105 г при 270 С і тиску 1,013. 105 Па займає об’єм 0,8 л. Визначити його відносну молекулярну масу
7. Густина газу за киснем дорівнює 2. Визначити його густину за: а) воднем; б) карбон(IV) оксидом.
8. Газ массою 75 г (н.у.) займає об'єм 56 л. Визначити його відносну молекулярну масу.
9. Озон масою 2,14 кг (н.у.) займає об’єм 1 м3. Визначити формулу озону.
10. Який газ важчий і в скільки разів: а) Не або СО2; б) NH3 або РН3; в) О3 або СН4?
11. Визначити молярну масу еквівалента для: 1) Н3РО4 в реакціях з NaOH, які призводять до утворення NaН2РО4, Na2HPO4, Na3PO4; 2) Fe(OH)3 в реакціях з H2SO4, в результаті яких утворюється [Fe(OH)2]2SO4, FeOHSO4, Fe2(SO4)3.
12. Визначити кількість речовини еквівалента кислот: нітратної, сульфатної та ортофосфатної, взятих масою, яка відповідно дорівнює 189, 196 та 163 г.
13. Визначити: а) n(1/3 Н3РО4), якщо n(H3РО4) = 6 моль; б) n(1/2 Н2SО4), якщо n(H2SО4) = 4 моль.
14. Метал масою 3,006 г взаємодіє з сіркою масою 1,635 г; М(1/2S) = 16,03 г/моль. Визначити МЕ (М(fЕКВ(х)) цього металу.
15. Визначити МЕ(М(fЕКВ(х)) для елемента, що утворює з Бромом сполуку, в якій масова частка брому складає 80%.
16. При розчиненні в кислоті металу масою 11,9 г виділився водень об’ємом 2,24 л (н.у.). Визначити fЕКВ(х) та МЕ(М(fЕКВ(х)Х) для цього металу.
17. Визначити молярну масу еквівалента металу, якщо його наважка масою 20 г витісняє з кислоти водень об’ємом 7,5 л при 180 С і тиску 1,013 . 105 Па.
Всі хімічні речовини поділяються на прості (елементарні) і складні (сполуки). Прості речовини поділяються на метали і неметали. Серед складних речовин виділяють органічні і неорганічні. Органічні сполуки вивчає органічна хімія. Неорганічні поділяють на класи, серед яких найбільш важливими є оксиди, гідроксиди, кислоти і солі.
Останнім часом пропонується латинізований варіант систематичних назв елементів. Для простих речовин зберігаються тривіальні (старі) назви. Систематичні назви елементів необхідно писати з великої літери.
Наприклад, N – Нітроген - назва елемента систематична;
N2 – азот - традиційна назва простої речовини;
Fe – Ферум - назва елемента, залізо – традиційна назва простої речовини.
Оксиди
Оксиди – це сполуки елементів з Оксигеном, в яких він має ступінь окиснення – 2.
В оксидах атоми Оксигену сполучаються з атомами інших елементів і не зв'язані між собою.
Сполуки елементів з Оксигеном, в молекулах яких є зв’язок між двома атомами Оксигену, називають пероксидами (Н2О2 – гідроген пероксид Н-О-О-Н, Na2O2 – натрій пероксид Na-О-О-Na).
Пероксиди металів належать до класу солей, гідроген пероксид має кислотні властивості.
Назви оксидів можна побудувати двома способами: за допомогою числових префіксів або вказуючи ступінь окиснення елемента, якщо він змінний. Спочатку називають елемент, потім додають слово „оксид”:
Sb2O3 – дистибій триоксид або стибій(ІІІ) оксид,
N2О5 – динітроген пентаоксид або нітроген(V) оксид,
ВаО – барій оксид,
B2О3 – бор оксид,
К2О – калій оксид.
Деякі оксиди мають технічні назви: СаО – негашене або палене вапно, його застосовують в меліорації кислих грунтів (вапнування), в будівництві для виготовлення будівельних розчинів, грунтовки та побілки стін; MgO – палена магнезія, завдяки високій температурі плавлення (близько 30000С) застосовують для виготовлення вогнетривких тиглів, труб, цегли, а також магнезіального цементу. Покращує структуру кислих грунтів.
Велика кількість мінералів – оксиди: SiO2 – кварц, Al2O3 – глинозем.
Оксиди поділяють на несолетворні і солетворні. Несолетворні оксиди не утворюють гідратних сполук і солей. Прикладом несолетворних оксидів можуть бути N2O, NO, CO. За хімічними властивостями солетворні оксиди поділяють на основні, кислотні і амфотерні, які виявляють кислотно-основну двоїстість.
Основними називаються оксиди, гідрати яких є основами.
Утворюють основні оксиди активні метали, а такожперехідні метали в нижчих ступенях окиснення (+1, +2): Na2O, CaO, MgO, MnO, NiO. Головна їх властивість – здатність реагувати з кислотними оксидами та їх гідратами -кислотами з утворенням солей:
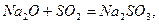


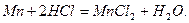
Реакція кальцій оксиду (негашене вапно) з карбон(IV) оксидом пояснює, чому не можна залишати вапно на повітрі: воно перетворюється в сіль – кальцій карбонат.
Оксиди лужних (Li, Na, K, Rb, Cs, Fr) та лужноземельних (Ca, Sr, Ba, Ra) металів розчиняються у воді, утворюючи розчинні у воді гідроксиди (луги), які забарвлюють індикатори фенолфталеїн в малиновий колір, а лакмус – в синій

 - реакція гасіння вапна
- реакція гасіння вапна
Оксиди інших металів у воді не розчиняються, їх гідроксиди також нерозчинні у воді. Одержати їх можна непрямим шляхом:

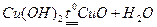 .
.
Кислотними називаються оксиди, гідрати яких є кислотами.
Кислотні оксиди утворюють неметали (B2O3, CO2, SO2, SO3, N2O5, P2O5), а також перехідні метали у вищому ступені окиснення (CrO3, Mn2O7). Майже всі кислотні оксиди, окрім SiO2 і деяких інших, розчиняються у воді з утворенням кислот:
СО2 + Н2О = Н2СО3 – карбонатна кислота;
N2O5 + H2O = 2HNO3 – нітратна кислота;
Р2О5 + 3Н2О = 2Н3РО4 – ортофосфатна кислота;
Mn2O7 + H2O = 2 H MnO4 – манганатна(VII).
Кислоти, які відповідають нерозчинним у воді кислотним оксидам, одержують непрямим шляхом:
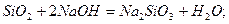

| метасилікатна кислота |
Кислотні оксиди можуть бути одержані шляхом відбирання води від відповідних оксигеновмісних кислот, тому їх називають ангідридами кислот (ангідрид – безводний):
2HNO3 = H2O + N2O5 – нітратний ангідрид;
H2SO4 = H2O + SO3 – сульфатний ангідрид;
H2SO3 = H2O + SO2 – cульфатний(IV) ангідрид (сульфітний).
Найбільш характерні хімічні властивості кислотних оксидів – взаємодія з основами та основними оксидами:

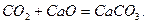
Амфотерні оксиди – це сполуки, які мають слабко виражені і кислотні, і основні властивості, тобто здатні реагувати і з сильними основами, і з сильними кислотами з утворенням солей.
До них належать оксиди деяких малоактивних металів (ВеО, Al2О3), а також перехідних металів в проміжному ступені окиснення (Cr2O3, MnO2, SnO2).
У перехідних металів із змінним ступенем окиснення з підвищенням ступеня окиснення хімічний характер оксидів змінюється від основного через амфотерний до кислотного:
| +2 | +3 | +6 |
| CrO | Cr2O3 | CrO3 |
| основний | амфотерний | кислотний |
Амфотерні оксиди реагують з кислотними оксидами та кислотами як основні оксиди з утворенням відповідних солей:
сплавлення
 алюміній метасилікат
алюміній метасилікат
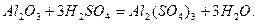 алюміній сульфат
алюміній сульфат
| |
При сплавленні амфотерних оксидів з оксидами, гідроксидами або карбонатами лужних та лужноземельних металів утворюються солі цих металів:

кальцій цинкат

натрій метаалюмінат

натрій ортоалюмінат

натрій метаалюмінат
Одержані солі жадібно поглинають воду з утворенням комплексних сполук:
NaAlO2 + 2H2O = Na[Al(OH)4] – натрій тетрагідроксоалюмінат;
Na3AlO3 + 3H2O = Na3[Al(OH)6] – натрій гексагідроксо-алюмінат.
Також комплексні солі утворюються безпосередньо при розчиненні амфотерних оксидів в концентрованих водних розчинах лугів:

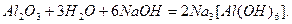
Оксиди бувають тверді (ВaO, Cu2O, CuO, P2O5, CaO, FeO, CrO3, SiO2 тощо), рідкі (Сl2 O7, Mn2O7) та газоподібні (CO, CO2, N2O, SO2).
Основи
Основи (основні гідроксиди) – це сполуки, які в водних розчинах дисоціюють з утворенням гідроксид-йонів ОН- та йонів основних залишків.
Назви основ утворюють з назви катіона і слова „гідроксид”, вказуючи ступінь окиснення, якщо він змінний, або додаючи відповідні числові префікси:
Fe(OH)2 – ферум(ІІ) гідроксид, або ферум дигідроксид;
Fe(OH)3 – ферум(ІІІ) гідроксид, або ферум тригідроксид.
Розчинні у воді гідроксиди лужних і лужноземельних металів називають лугами. Більшість гідроксидів нерозчинна у воді.
Найважливіша хімічна властивість основ – здатність утворювати солі з кислотними оксидами та кислотами:
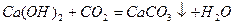
Mg(OH)2 + H2SO4 = MgSO4 +2 H2O.
Амфотерні гідроксиди
Амфотерні гідроксиди – це гідратні сполуки амфотерних оксидів. Як і амфотерні оксиди, вони можуть утворювати солі як з кислотами, так і з основами. В кислому середовищі вони виявляють властивості основ, а в лужному – кислот:

цинк хлорид
 сплавлення
сплавлення
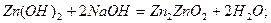
натрій цинкат
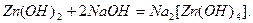
конц. натрій тетрагідроксоцинкат
розчин
Кислоти
Кислотами називають речовини, які в водних розчинах дисоціюють на катіони Гідрогену та аніони кислотних залишків. Кислоти поділяють на безоксигенні (HCl, HBr, H2S тощо) та оксигеновмісні (HNO3, H2SO4, H2CO3 тощо). В залежності від числа йонів Гідрогену, що утворюються при дисоціації, розрізняють кислоти одноосновні (HNO2, HCl), двоосновні (H2S, H2SO4), триос-новні (Н3РО4, Н3РО3).
Таблиця 5
Систематичні і традиційні назви кислот і кислотних залишків
| Формула | Систематична назва кислоти | Традиційна назва кислоти | Назва кислотного залишку |
| HF | Флуоридна | Фтороводнева | Флуорид |
| HCl | Хлоридна | Хлороводнева (соляна) | Хлорид |
| HBr | Бромідна | Бромоводнева | Бромід |
| HI | Йодидна | Йодоводнева | Йодид |
| H2S | Сульфідна | Сірководнева | Сульфід |
| H3BO4 | Боратна | Борна | Борат |
| H2CO3 | Карбонатна | Вугільна | Карбонат |
| H2SiO3 | Силікатна | Кремнієва | Силікат |
| H3PO4 | Фосфатна | Фосфорна | Фосфат |
| HNO3 | Нітратна | Азотна | Нітрат |
| HNO2 | Нітратна(ІІІ), нітритна | Азотиста | Нітрит |
| H2SO4 | Сульфатна | Сірчана | Сульфат |
| H2SO3 | Сульфатна(IV), сульфітна | Сірчиста | Сульфіт |
| HСlO4 | Хлоратна | Хлорна | Хлорат |
Назви кислот утворюють з назви елемента, характерного для кислотного залишку, вказуючи при необхідності ступінь окиснення.
Якщо оксигеновмісна кислота містить елемент у найвищому ступені окиснення, то ступінь окиснення можна не вказувати.
Один і той самий ангідрид (наприклад, фосфатний) може утворювати декілька кислот, що відрізняються між собою числом молекул води. При цьому найбагатша на воду форма має приставку орто-, а найбідніша – мета:
Р2О5 + Н2О = 2 НРО3 – метафосфатна кислота;
Р2О5 + 2 Н2О = Н4Р2О7 – дифосфатна кислота;
Р2О5 + 3 Н2О = 2 Н3РО4 – ортофосфатна кислота.
Кислотний залишок – це група атомів, яка залишається від кислоти при частковому або повному заміщенні Гідрогену. Валентність кислотного залишку визначається числом заміщених атомів Гідрогену.
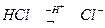 - хлорид-йон
- хлорид-йон
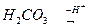
| 
| 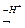
| 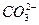
|
| гідрогенкарбонат-йон | карбонат-йон |
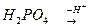
| 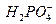
| 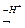
| 
| 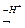
| 
|
| дигідроген-фосфат-йон | гідроген- фосфат-йон | фосфат- йон |
Кількість кислотних залишків відповідає кількості атомів Гідрогену в кислоті, які можуть бути заміщені на атоми металу або можуть утворитись при дисоціації, тобто її основності.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 748; Нарушение авторских прав?; Мы поможем в написании вашей работы!