
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контрольні питання
|
|
|
|
1. Наведіть приклади буферних розчинів утворених слабкою кислотою і її сіллю.
2. Наведіть приклади буферних розчинів утворених слабкою основою і її сіллю.
3. Наведіть приклади буферних розчинів утворених солями багатоосновних кислот.
4. Напишіть рівняння реакції дії на гідрокарбонатний буферний розчин кислоти, лугу.
4. Напишіть рівняння реакції дії на фосфатний буферний розчин кислоти, лугу.
5. Напишіть рівняння реакції дії на ацетатний буферний розчин лугу, кислоти.
6. Напишіть рівняння реакції дії на білковий буферний розчин кислоти, лугу.
7. Як розрахувати рН кислотного буферного розчину?
8. Як розрахувати рН основного буферного розчину?
9. Що таке буферний розчин? Фактори від яких залежить рН буферного розчину.
10.Як розрахувати рН буферного розчину?
11.Аміачна буферна система складається з 100 мл розчину гідроксиду амонію з молярною концентрацією еквівалентів 0,1 моль/л і 50 мл хлориду амонію з молярною концентрацією еквівалентів 0,2 моль/л. (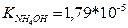 ). Визначити рН даної системи.
). Визначити рН даної системи.
12.Як зміниться рН даного аміачного буферу при доливанні до нього 10 мл розчину кислоти з молярною концентрацією еквівалентів 0,2 моль/л.
13.Розрахуйте які об’єми розчинів гідрофосфату і дигідрофосфату натрію з молярними концентраціями еквівалентів 0,1 моль/л треба взяти для приготування 100 мл буферного розчину з рН 6,8. (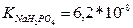 )
)
14.Як зміниться рН даного фосфатного буферу при доливанні до нього 40 мл розчину лугу з молярною концентрацією еквівалентів 0,1 моль/л.
Самостійна робота на занятті.
Виконати лабораторні роботи
1. Приготувати ацетатний буферний розчин за заданим співвідношенням компонентів.
2. Приготувати буферний розчин за відомим значенням рН.
3. Вивчити властивості буферного розчину.
Методика виконання роботи
Робота 1. Приготування ацетатного буферного розчину за заданим співвідношенням компонентів.
Кожна пара студентів готує 10 мл ацетатного буферу змішуючи 0,1 н розчини оцтової кислоти і ацетату натрію з вказаним викладачем співвідношенням (кислота:сіль=9:1;8:2; 7:3; 6:4; 5:5; 4:6; 3:7; 2:8; 1:9).
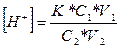
Концентрацію водневих іонів в буферному розчині визначають за формулою:
де К - константа дисоціації оцтової кислоти (1,8*10-5);
С1, V1, - об'єм і еквівалент розчину кислоти;
С2, V2 - еквівалент і об'єм розчину солі.
На основі знайденої концентрації водневих іонів буферного розчину вираховують рН за формулою:
рН = -lg [Н+].
Одержані дані занести в таблицю.
| №п/п | Vкислоти | Vсолі | [ H+ ] | рН |
За співвідношенням компонентів і рН буферних розчинів будують буферну криву в координатах рН®VK.
Робота 2. Приготування буферного розчину за відомим рН.
Студенти одержують завдання від викладача на приготування 10 мл буферного розчину з певним значенням рН. За відомим значенням рН розраховують концентрацію йонів водню в розчині.
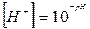
Об'єм розчину кислоти і солі визначають за формулою:
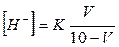
 де К - константа дисоціації оцтової кислоти (1,8 • 10-5);
де К - константа дисоціації оцтової кислоти (1,8 • 10-5);
V - об'єм розчину кислоти; 10-V -об'єм розчину солі.
Робота 3. Властивості буферного розчину.
Необхідно перевірити, чи змінюється рН буферної суміші при доливанні кислоти або лугу (збільшенні концентрації), або доливанні води (зменшенні концентрації). Для цього в 4 пробірки налити по 2 мл приготовленого буферного розчину (роб.1). В першу пробірку прилити 2 кр 0,1М NaOH, в другу – 2 кр. 0,1 М НСІ, в третю – 2 кр. Н2О. Четверта пробірка служить еталоном. В кожну пробірку прилити по 2-3 кр індикатора метилоранжу. Що спостерігається? Записати рівняння відповідних реакцій.
Заняття 11
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 747; Нарушение авторских прав?; Мы поможем в написании вашей работы!