
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні поняття і закони хімії
|
|
|
|
Речовини складаються з атомів або молекул, певним чином пов’язаних між собою.
Маси атомів та молекул дуже малі, тому для порівняння їх мас зручно користуватися відносними атомними і молекулярними масами, які показують, у скільки разів атом чи молекула є легшими або важчими від стандартної величини. На даний час як стандарт використовують атомну одиницю маси.
Атомна одиниця маси (а.о.м.) – це 1/12 частка від маси атома ізотопу Карбону 12С.
Атомна одиниця масименша від звичайної стандартної маси (у грамах) у 6,02∙1023 разів. Тому справедливе співвідношення:
1 а.о.м. ∙ 6,02∙1023 = 1 г
Маса атома, виражена в а.о.м., називається відносною атомною масою (Ar ). Вона є безрозмірною величиною. Атомні маси хімічних елементів зазначені в періодичній системі елементів.
Молекулярна маса (Mr ) – маса молекули, виражена в атомних одиницях маси. Вона також є безрозмірною величиною. Молекулярні маси сполук дорівнюють сумі мас атомів, що утворюють молекулу.
Наприклад, атомна маса Гідрогену Аr (H) = 1, Аr (Be) = 9, Аr (O) = 16, Аr (Mg) = 24, відповідно, маса молекули водню, що складається з двох атомів Гідрогену Mr (H2) = 2·1 = 2, аналогічно, Mr (N2) = 2·14 = 28, Mr (CO2) = 12 + 2·16 = 44,
Mr (H2SO4) = 2·1 + 32 + 4·16 = 98.
Наприклад, відносна атомна маса Магнію становить 24. Це означає, що атом Магнію „важчий“ від атома Гідрогену в 24/1 = 24 рази, від молекули водню в 24/2 = 12 разів, від атома Карбону в 24/12 – вдвічі,від атома Оксигену в 24/16 = 1,5рази, від атома Сульфуру в 24/32 = 0,75 разів, тобто „легший“ у 32/24 = 1,33 рази.
У хімії користуються фізичною величиною, яка називається кількістю речовини (ν). Одиницею вимірювання кількості речовини є моль.

Експериментально встановлено, що у 12 г ізотопу Карбону 12С міститься6,02·1023 атомів. Отже, 1 моль будь-якої речовини містить 6,02·1023 структурних частинок (атомів, молекул, йонів тощо). Це число називають сталою Авогадро (NA ).
Маса 1 моля речовининазивається мольною (молярною) масою речовини (M). Мольна маса речовини чисельно дорівнює відносній атомній або молекулярній масі; одиниці розмірності - г/моль.
Наприклад, мольна маса атомарного Гідрогену дорівнює 1 г/моль, молекулярного водню 2 г/моль, сульфатної кислоти 98 г/моль.
При розв’язку задач зручно використовувати такі формули:
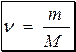
де m – маса речовини, г;
M – мольна маса, г/моль;

де N – число структурних одиниць;
NA – стала Авогадро, NA = 6,02·1023 моль–1.
Згідно із законом сталості складу елементи сполучаються один з одним у строго визначених вагових співвідношеннях. Найменші вагові співвідношення називаються хімічними еквівалентами (сполучними масами), що означає – рівноцінна кількість.


Масу одного еквівалента речовини називають еквівалентною масою (мольною масою еквівалента Е), одиниці вимірювання якої – г/моль-екв.
Наприклад, у НВr з одним молем атомів Гідрогену сполучається 1 моль атомів Брому, тому еквівалент Брому в цій сполуці дорівнює одному молю атомів Брому, а його еквівалентна маса дорівнює 80 г/моль-екв.
У Н2О з одним молем атомів Гідрогену сполучається 1/2моль атомів Оксигену, тому еквівалент Оксигену у цій сполуці дорівнює 1/2 моль атомів Оксигену, а його еквівалентна маса дорівнює 16/2 = 8 г/моль-екв.
Отже, зрозуміло, що в хімічних реакціях різні індивідуальні речовини беруть участь у строго еквівалентних кількостях. Це твердження є основою закону еквівалентів:

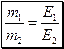
Еквівалентні маси елементів визначають за формулою:

де М – мольна маса елемента;
В – валентність елемента.
Наприклад, Е (Al)= 27/3 = 9 г/моль-екв.
Еквівалентні маси складних речовин визначаються за наступними формулами.
Еквівалентна маса кислоти:

Основність кислоти визначається кількістю катіонів Гідрогену в молекулі кислоти, здатних заміщатися на катіони металу.
Еквівалентна маса основи:
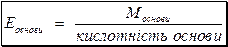
Кислотність основи визначається кількістю гідроксильних груп в молекулі основи, що заміщуються на кислотні залишки.
Еквівалентна маса солі:

де n – число атомів металу;
В – валентність металу.
Для визначення кількості еквівалентів (nекв) речовини, що має певну масу m, використовують формулу:

Встановлено, що один моль будь-якого газу за однакових умов займає певний об’єм, оскільки згідно із законом Авогадро у однакових об’ємах газів за однакових умов міститься однакова кількість молекул.
За нормальних умов (н.у.):
· тиск 1 атм = 760 мм рт.ст. = 101325 Па,
· температура 0°С = 273 К
об’єм 1 моль будь–якого газу дорівнює 22,4 дм3.
Стала Vm = 22,4 дм3/моль називається молярним об’ємом газу за нормальних умов.

За будь-яких умов молярний об’єм газу – це величина, що дорівнює відношенню об’єму газу за даних умов до кількості речовини цього газу:

де Vm – молярний об’єм газу за даних (будь-яких) умов, дм3/моль;
V – об’єм газу за даних (будь-яких) умов, дм3;
ν – кількість речовини газу, моль.
За стандартних умов (тиск 1 атм. (101325 Па) і температури 298,15 К або 25 °С) молярний об’єм газу дорівнює не 22,4, а 24,4 дм3/моль.
Відношення маси певного об’єму одного газу до маси такого самого об’єму іншого газу (взятого за тих самих умов) називається відносною густиною першого газу за другим  .
.
Якщо об’єми газів, що порівнюють між собою, однакові, то відносна густина визначається за формулою:

де m1 і m2 – маси однакових об’ємів газів 1 і 2 за однакових температури і тиску.
Відповідно можна записати, що:

де M1 і M2 – мольні маси газів 1 і 2.
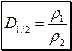
де ρ1 і ρ2 – густини газу 1 та газу 2.
Отже, густини різних газів, узятих за однакових умов, пропорційні їх молярним масам:

Якщо умови відмінні від нормальних, то для розрахунку параметрів газів використовують рівняння Клапейрона–Менделєєва:

де М – мольна маса газу, г/моль;
m – маса газу, г;
Т – температура, К, Т = tо + 273;
V – об’єм газу, м3,
р – тиск газу, Па, (1 атм. = 101325 Па, 1 мм рт.ст. = 133,322 Па);
R = 8,31 Дж/К·моль – універсальна газова cтала.
Виходячи із формул речовин можна дати їх кількісну характеристику, зокрема, визначати масову частку кожного хімічного елемента у сполуці.
Масова частка (ω) показує, яку частину становить маса даного елемента від всієї маси речовини:

n – кількість атомів елемента у сполуці;
Ar – атомна маса елемента;
Mr – молекулярна маса.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 572; Нарушение авторских прав?; Мы поможем в написании вашей работы!