
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура кислот
|
|
|
|
Кислоти – це складні речовини, до складу яких входять атоми Гідрогену, здатні заміщуватися на атоми металу.
Кислоти
Хімічні властивості основ
1 Взаємодія з кислотами:
3LiOH + H3PO4 = Li3PO4 + 3H2O,
2 Взаємодія з кислотними оксидами:
Sr(OH)2 + SO3 = SrSO4 + H2O,
(SO3+ H2O → H2 SO4).
3 Взаємодія з амфотерними оксидами:
2RbOH + BeO = Rb2BeO2 + H2O,
(BeO + H2O → H2 BeO2).
4 Взаємодія амфотерними гідроксидами:
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O,
Zn(OH)2 ↔ H2 ZnO2.
З точки зору теорії електролітичної дисоціації кислотами називають електроліти, при дисоціації яких у вигляді катіонів утворюються лише H+-катіони.
Кислоти класифікують:
- за основністю (аналогічно основам).
- за наявністю Оксигену в молекулі - на безоксигенові та оксигеновмісні.
Назви безоксигенових кислот складаються з назви кислотоутворювального елемента з додаванням суфікса -ідн-,
-идн- та слова «кислота» (див. додаток Г):
Н2Se – селенідна кислота, H2S – сульфідна кислота, HBr – бромідна кислота. До безоксигенових кислот належать також ціанідна HСN, роданідна HNCS.
Назви оксигеновмісних кислот
Для написання назви оксигеновмісної кислоти необхідно вміти розраховувати ступінь окиснення кислотоутворювального елемента. Для цього треба пам’ятати, що ступінь окиснення Гідрогену дорівнює +1, ступінь окиснення Оксигену дорівнює -2, а молекула в цілому є електронейтральною. Наприклад, для визначення ступеня окиснення Сульфуру в H2SO4необхідно додати ступені окиснення Гідрогену та Оксигену з врахуванням числа їх атомів
2·(+ 1) + 4·(–2) = –6
та одержане число взяти з протилежним знаком. Тоді ступінь окиснення Сульфуру в H2SO4дорівнює +6.
Для визначення ступеня окиснення Фосфору в H4Р2O7необхідно додати ступені окиснення Гідрогену та Оксигену з врахуванням числа їх атомів
4·(+ 1) + 7·(–2) = –10
та одержане число взяти з протилежним знаком і поділити його на кількість атомів фосфору (2). Тоді ступінь окиснення Фосфору в H4Р2O7дорівнює +10/2=+5.
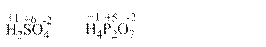
1. Якщо кислотоутворювальний елемент проявляє в кислотах тільки один ступінь окиснення, то у назвах кисневмісних кислот до кореня латинської назви відповідного елемента додають суфікс „ат“.
Наприклад: C+4, H2СO3 – карбонатна кислота.
2. Якщо елемент здатний проявляти два ступені окиснення, то у вищому ступені окиснення в назві кислоти застосовується суфікс „ат“, а у нижчому – „ит“ або „іт“.
Наприклад: N+3, HNO2 – нітритна кислота,
N+5, HNO3 – нітратна кислота,
S+4, H2SO3 – сульфітна кислота,
S+6, H2SO4 – сульфатна кислота.
3 Якщо елемент здатний проявляти більшу кількість ступенів окиснення, то до кореня латинської назви елемента додають:
· при найнижчому ступені окиснення – префікс „гіпо“ та суфікс „ит“ або „іт“,
· при дещо вищому ступені окиснення – суфікс „ит“ або „іт“,
· при ще вищому ступені окиснення – суфікс „ат“,
· при найвищому ступені окиснення – префікс „пер“ та суфікс „ат“.
Наприклад: Cl+1, HClO – гіпохлоритна кислота,
Cl+3, HClO2 – хлоритна кислота,
Cl+5, HClO3 – хлоратна кислота,
Cl+7, HClO4 – перхлоратна кислота.
4 Якщо до складу кислоти входять два або більше атомів кислотоутворювального елемента, то для позначення їх кількості в назві кислоти застосовують префікс – відповідний грецький числівник.
Наприклад: H2Cr2O7 – дихроматна кислота,
H4P2O7 – дифосфатна кислота,
H2B4O7 – тетраборатна кислота.
Для двох кислот того жангідриду, які відрізняються вмістом води, назви утворюють так: до назви аніону кислоти з меншим вмістом води додають префікс „мета“, з більшим вмістом води – префікс „орто“.
Наприклад:
P2O5 + H2O = 2HPO3
мета фосфатна кислота,
P2O5 + 3H2O = 2H3PO4
орто фосфатна кислота,
B2O3 + H2O = 2HBO2
мета боратна кислота,
B2O5 + 3H2O = H3BO3
орто боратна кислота.
Назви деяких оксигеновмісних кислот наведено в додатку Г.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1033; Нарушение авторских прав?; Мы поможем в написании вашей работы!