
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакції, які супроводжуються зміною ступеня окиснення атомів реагуючих речовин, називають окисно-відновними
|
|
|
|
ОКИСНО-ВІДНОВНІ ПРОЦЕСИ
КОНТРОЛЬНІ ЗАВДАННЯ
1. Для сполуки [Co(H2O)(NH3)5]F2:
а) визначте заряд комплексного йону;
б) ступінь окиснення комплексоутворювача;
в) його координаційне число;
г) назвіть ліганди;
д) назвіть комплексну сполуку;
е) напишіть рівняння реакцій її первинної та вторинної дисоціації.
2. Для сполуки K3[Fe(H2O)(CN)5]:
а) визначте заряд комплексного йону;
б) ступінь окиснення комплексоутворювача;
в) його координаційне число;
г) назвіть ліганди;
д) назвіть комплексну сполуку;
е) напишіть рівняння реакцій її первинної та вторинної дисоціації.
3. Напишіть хімічні формули таких сполук:
літій тетрахлороберилат, тетрааміндиаквахром(ІІІ) нітрат,
гексаамінкобальт(ІІІ) сульфат.
Атоми, йони або молекули, які віддають електрони (збільшують ступінь окиснення), називають відновниками. В реакції відновники окиснюються.
Атоми, молекули або йони, які приєднують електрони (зменшують ступінь окиснення) називають окисниками. Під час реакції вони відновлюються.
Процес приєднання електронів атомом, молекулою або йоном називається відновленням.
Процес віддачі електронів називається окисненням. Кількість електронів, що їх віддає відновник має дорівнювати кількості електронів, які приєднує окисник. Ці процеси нерозривно пов’язані між собою. Сполуки, до складу яких входять елементи з найвищим ступенем окиснення, можуть бути в окисно-відновних реакціях лише окисниками. Сполуки, до складу яких входять елементи з найнижчим ступенем окиснення, можуть бути в окисно-відновних реакціях лише відновниками. Сполуки, до складу яких входять елементи з проміжним ступенем окиснення, здатні бути як окисниками, так і відновниками.
Для урівнювання рівнянь окисно-відновних реакцій застосовують метод електронного балансу.
Схема методу така:
- записують рівняння реакції;
- визначають ступені окиснення атомів усіх елементів;
- визначають атоми елементів, які змінили ступені окиснення – окисник (и) та відновник (и);
- складають електронні рівняння для окисника та відновника;
- визначають головні коефіцієнти рівняння;
- урівнюють метали;
- урівнюють неметали (крім Гідрогену та Оксигену);
- урівнюють атоми Гідрогену;
- визначають баланс атомів Оксигену.
Приклад 1:
K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
Визначаємо ступені окиснення елементів у даному рівнянні:
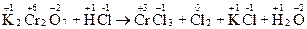 .
.
Ступінь окиснення змінили атоми Хром та Хлор.
Складаємо електронні рівняння з урахуванням індексів, які стоять біля елементів у формулах:
2Cl– - 2e = Cl20,
2Cr+6 + 6e = 2Cr+3.
Визначаємо коефіцієнти для окисника та відновника, враховуючи, що кількість електронів, які віддає відновник, має дорівнювати кількості електронів, які приєднує окисник. Для цього знаходимо найменше спільне кратне (НСК) кількості відданих та приєднаних електронів. Діленням НСК на кількість електронів, які беруть участь у процесах окиснення та відновлення, знаходимо коефіцієнти для окисника та відновника:
| 2Cl– - 2e = Cl20 | |
| 2Cr+6 + 6e = 2Cr+3 |
Знайдені коефіцієнти підставляємо в рівняння реакції:
K2Cr2O7 + HCl → 2 CrCl3 + 3 Cl2 + KCl + H2O.
У цьому рівнянні коефіцієнт перед HCl не ставимо, так як частина HCl використовується для утворення CrCl3 і KCl. Далі урівнюємо кількість йонів металів, які не змінили ступені окиснення (калію).
K2Cr2O7 + HCl → 2 CrCl3 + 3Cl2 + 2KCl + H2O.
Тепер весь Хлор справа урівняний, тому ставимо коефіцієнт перед HCl.
K2Cr2O7 + 14 HCl → 2 CrCl3 + 3 Cl2 + 2 KCl + H2O.
Потім урівнюємо Гідроген, і перевірямо баланс за Оксигеном. Одержуємо повністю складене та урівняне рівняння.
K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O.
Визначаємо і записуємо окисник і відновник та процеси окиснення та відновлення:
| відновник - HCl; | |||
| окисник - K2Cr2O7. | |||
| 2Cl– - 2e = Cl20 | процес окиснення | ||
| 2Cr+6 + 6e = 2Cr+3 | процес відновлення | ||
Приклад 2:
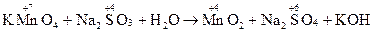
| Окисник KMnO4 | Mn+7 + 3ē → Mn+4 | процес відновлення | |
| Відновник Na2SO3 | S+4− 2ē → S+6 | процес окиснення |
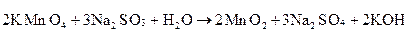
Приклад 3:
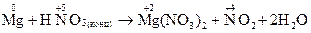
| Відновник (Mg) | Mg0 – 2ē → Mg+2 | процес окиснення | |
| Окисник (HNO3) | N+5+ 1ē → N+4 | процес відновлення |
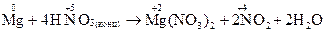
Приклад 4:
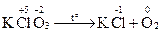
| Відновник | 2O-2 − 4ē → O20 | процес окиснення | |
| Окисник | Сl+5+ 6ē → Cl-1 | процес відновлення |
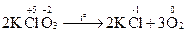
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 698; Нарушение авторских прав?; Мы поможем в написании вашей работы!