
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи виразу складу розчинів
|
|
|
|
Розчини - гомогенні (однорідні) системи, які складаються з розчинника, розчинених речовин та продуктів їх взаємодії.
РОЗЧИНИ. ГІДРОЛІЗ СОЛЕЙ
КОНТРОЛЬНІ ЗАВДАННЯ
Для реакцій:
N2(г) + 3Н2(г) «2NH3(г), ΔН = –92 кДж;
Fe2O3(т) + 3H2(г) «2Fe(т) + 3H2O(г), ΔН = 97 кДж
1. Напишіть кінетичні рівняння прямої та зворотної реакції.
2. Напишіть вираз для константи рівноваги даної реакції.
3. У скільки разів збільшиться або зменшиться швидкість прямої реакції при збільшенні концентрації Н2 в 3 рази?
4. У скільки разів збільшиться або зменшиться швидкість прямої реакції при збільшенні об’єму системи в 2 рази?
5. У скільки разів збільшиться або зменшиться швидкість зворотної реакції при збільшенні тиску в системі в 3 рази?
6. У скільки разів збільшиться швидкість прямої реакції при зміні температури від 100 оС до 130 оС. Температурний коефіцієнт реакції 3.
7. В яку сторону зміститься рівновага реакції:
а) при підвищенні температури;
б) при підвищенні тиску.
Залежно від агрегатного стану розчинника розрізняють тверді, рідкі і газуваті розчини.
Насичений розчин – розчин, у якому за певної температури дана речовина більше не розчиняється.
Ненасичений розчин – розчин, у якому за певної температури дана речовина ще може розчинятися.
Розчинність – максимальна маса речовини, яка може розчинитись у 100 г розчинника.
1) масова частка ω - це відношення маси розчиненої речовини до загальної маси розчину:
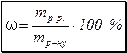
де ω – масова частка розчиненої речовини;
тр.р. – маса розчиненої речовини, г;
тр-ну – маса розчину, г.
Масову частку розчиненої речовини ω виражають у частках одиниці або у відсотках.
2) молярна концентрація См (молярність) розчину - це відношення кількості розчиненої речовини до об’єму розчину:
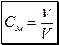
Одиниці вимірювання См – моль/дм3.
Водневий показник рН – це від’ємний десятковий логарифм концентрації йонів Гідрогену.
рН = ‑ lg [Н+]
w кислі розчини: рН < 7
w нейтральні розчини: рН = 7
w лужні розчини: рН > 7
Аналогічно водневому показнику введено поняття показника гідроксил-йонів:
рОН = – lg [OН–].
Тоді за температури 298 К справджується рівність:
рН + рОН = 14.
Гідроліз - це хімічна взаємодія солей з малодисоційованими молекулами води, яка призводить до утворення ще слабшого електроліту. Ця реакція є зворотною до реакції нейтралізації. Усі солі за будовою молекули можна поділити на чотири типи:
- солі І типу – утворені сильною кислотою та сильною основою (KNO3, BaCl2 тощо);
- солі ІІ типу – утворені сильною кислотою та слабкою основою (Zn(NO3)2, CuSO4 тощо);
- солі ІІІ типу – утворені слабкою кислотою та сильною основою (Na2CO3, Li2SO3 тощо);
- солі ІV типу – утворені слабкою кислотою та слабкою основою ((NH4)2CO3, (CH3COO)2Pb тощо).
Хімічну взаємодію з молекулами води здійснюють лише утворені при дисоціації відповідних солей йони слабких електролітів (див. додаток Д). Таким чином, за механізмом перебігу реакцію гідролізу можна розділити на три типи (солі І типу не гідролізують).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2182; Нарушение авторских прав?; Мы поможем в написании вашей работы!