
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гідроліз солей ІV типу
|
|
|
|
Друга стадія.
Перша стадія.
Гідроліз солей ІІІ типу
Друга стадія.
Перша стадія.
Гідроліз солей ІІ типу
Кількість стадій гідролізу лімітується зарядом йону слабкого електроліту (катіону), який утворюється при дисоціації солі:
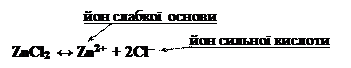
ZnCl2 + H2O ↔ ZnOHCl + HCl,
Zn2+ + 2Cl– + H2O ↔ ZnOH+ + Cl– + H+ + Cl–,
Zn2+ + H2O ↔ ZnOH+ + H+.
ZnOHCl + H2O ↔ Zn(OH)2 + HCl,
ZnOH+ + Cl– + H2O ↔ Zn(OH)2 + H+ + Cl–,
ZnOH+ + H2O ↔ Zn(OH)2 + H+.
Надлишок йонів Н+, що утворюється під час реакції зумовлює кислу реакцію середовища (рН < 7).
Кількість стадій гідролізу дорівнює кислотності слабкої основи.
Кількість стадій гідролізу лімітується зарядом йону слабкого електроліту (аніону), який утворюється при дисоціації солі:
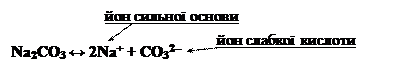
Na2CO3 + H2O ↔ NaHCO3 + NaOH,
2Na+ + CO32– + H2O ↔ Na+ + HCO3– + Na+ + OH–,
CO32– + H2O ↔ HCO3– + OH–.
NaHCO3 + H2O ↔ H2CO3 + NaOH,
Na+ + HCO3– + H2O ↔ H2CO3– + Na+ + OH–,
HCO3– + H2O ↔ H2CO3 + OH–.
Надлишок йонів OН–, що утворюється під час реакції зумовлює лужну реакцію середовища (рН > 7).
Кількість стадій гідролізу дорівнює основності слабкої кислоти.
Гідроліз солей ІV типу проходить в одну стадію незалежно від заряду катіону чи аніону.

CH3COONH4 + H2O = CH3COOH + NH4OH,
CH3COO– + NH4+ + H2O = CH3COOH + NH4OH.
Гідроліз солей цього типу проходить повністю або майже повністю і записується в одну стадію, незалежно від кислотності слабкої основи чи основності слабкої кислоти. Середовище можна вважати близьким до нейтрального (рН ≈ 7).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 502; Нарушение авторских прав?; Мы поможем в написании вашей работы!