
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електродні потенціали. Гальванічний елемент
|
|
|
|
Холодна концентрована нітратна кислота пасивує Al, Cr, Be, Pb, Sn, Mn, Fe внаслідок утворення на їх поверхнях захисних оксидних плівок.
Холодна концентрована H2SO4 пасивує Al, Сr, Fe внаслідок утворення на їх поверхнях захисних оксидних плівок.
При взаємодії розбавленої нітратної кислоти з малоактивними металами, які стоять в ряді активності після водню, а також з металами середньої активності відновлення проходить до NO. Розбавлена нітратна кислота може відновлюватися до NO, N2O, N2, NH3 або NH4NO3. Як правило, амоніак виділяється, коли беруть сильно розбавлену кислоту і активний метал. Амоніак, що виділяється, взаємодіє з нітратною кислотою, утворюючи амонійну сіль.
3Be + 8HNO3(p)  3Be(NO3)2 + 2NO + 4H2O
3Be(NO3)2 + 2NO + 4H2O
4Ca + 10HNO3(p) = 4Ca(NO3)2 + NH4NO3 + 3H2O
При дії концентрованої HNO3, яка реагує практично з усіма металами (див. схему), звичайно виділяється NO2, незалежно від активності металу.
Сu + 4HNО3(к) = Cu(NО3)2 + 2NO2 + 2H2O
Zn + 4HNО3(к) = Zn(NО3)2 + 2NO2 + 2H2O

Процеси взаємного перетворення хімічної і електричної форм енергії називають електрохімічними процесами. Вони найчастіше відбуваються у реальних системах, в яких існує контакт металічної поверхні з розчином електроліту. Провідники з електронною провідністю (провідники 1-го роду) називають електродами, а йонні провідники (провідники 2-го роду) – електролітами.
Здатність металів до утворення вільних позитивно заряджених йонів яскраво виявляється в реакціях витіснення металів з їхніх солей іншими, активнішими металами або під час взаємодії з кислотами-неокисниками. Так, якщо цинкову пластинку занурити в розчин купрум (ІІ) сульфату, то відбудеться окисно-відновна реакція
Zn + Cu2+ = Cu + Zn2+.
Ця реакція відбувається, наприклад, у гальванічному елементі, в якому цинкова пластинка (один електрод) занурена у розчин цинк сульфату, а мідна (другий електрод) – у розчин купрум (ІІ) сульфату (див. схему нижче). Цинк – активніший метал, тому між цинковим і мідним електродом виникає різниця потенціалів. Під’єднавши цинковий та мідний електроди до гальванометра і з’єднавши розчини U-подібною трубкою, заповненою розчином електроліту, отримують гальванічний елемент. Після встановлення у гальванічному колі контакту стрілка гальванометра відхиляється у напрямку до мідного електрода. Це свідчить про те, що під час роботи гальванічного елемента електрони рухаються від цинкового електрода до мідного.
Гальванічний елемент - це прилад, що служить для перетворення хімічної енергії окисно-відновної реакції на електричну. У гальванічному елементі електрони переходять від відновника до окисника не безпосередньо, а по провіднику електричного струму – по зовнішньому колу. Цей напрямлений потік електронів і є електричним струмом.
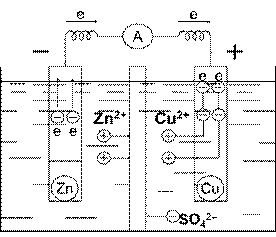
На цинковому електроді елемента відбувається розчинення цинку з перетворенням його атомів на йони, тобто процес окиснення:
Zn - 2 ē = Zn2+,
а вивільнені електрони по провіднику переходять на мідний електрод, де відбувається розряджання катіонів Купруму (процес відновлення), що супроводжується виділенням металічної міді:
Cu2+ + 2 ē = Cu.
Сумарне рівняння реакції, внаслідок якої у колі виникає електричний струм, матиме вигляд
Zn + Cu2+ = Zn2+ + Cu.
Електрод, на якому відбувається процес окиснення, називається анодом, а електрод, на якому відбувається процес відновлення,– катодом.
Схематично описаний гальванічний елемент записують так:
(–) Zn|ZnSO4||CuSO4|Cu (+),
Зліва записують анод, справа – катод. Однією вертикальною лінією вказується межа „метал-розчин“, двома – „розчин-розчин“.
Різниця потенціалів між електродами (φ) визначає напругу Е (електрорушійну силу) гальванічного елемента.
Для обчислення E від величини потенціалу катода слід відняти величину потенціалу анода.
Е = φк – φа,
φк – потенціал катоду, В;
φа – потенціал аноду, В.
Величина електродного потенціалу залежить від температури, концентрації йонів металу. Дана залежність електродного потенціалу виражається рівнянням Нернста:
φ = φ0  ,
,
де φ0 – стандартний електродний потенціал, В;
R – універсальна газова стала, 8,31 Дж/моль·К;
T – температура, К;
n – кількість електронів, що беруть участь у електрохімічному процесі;
F – стала Фарадея – 96500 Кл/моль;
[ Me n+ ] – концентрація йонів металу в розчині, моль∙екв/дм3.
Якщо перейти від натуральних логарифмів до десяткових, то, для стандартних умов:

|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1505; Нарушение авторских прав?; Мы поможем в написании вашей работы!