
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язку задач
При сталій температурі швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, взятих у степенях, які дорівнюють стехіометричним коефіцієнтам у відповідному рівнянні реакції.
ХІМІЧНА КІНЕТИКА. ХІМІЧНА РІВНОВАГА
КОНТРОЛЬНІ ЗАВДАННЯ
Для реакцій:
NaClO + KI + H2SO4 ® NaCl + I2 + K2SO4 + H2O,
K2Cr2O7 + Na2SO3 + H2SO4® Cr2(SO4)3 + K2SO4 +Na2SO4+ H2O,
Zn + HNO3(р) → Zn(NO3)2 + NH4NO3 + H2O,
CuS + HNO3 → Cu(NO3)2 + S + NO + H2O,
H2S + HNO3 → H2SO4 + NO2 + H2O,
K2MnO4 + H2O → KMnO4 + MnO2 + KOH,
H2S + HNO3 → H2SO4 + NO2 + H2O
1. Складіть електронні схеми.
2. Вкажіть процеси окиснення та відновлення.
3. Назвіть окисник та відновник.
4. Підберіть коефіцієнти та складіть повне рівняння реакції.
Хімічна кінетика – вчення про швидкість хімічних реакцій та про вплив на них різних факторів.
Швидкість хімічної реакції вимірюється зміною концентрації однієї з реагуючих речовин ΔС за одиницю часу Δτ
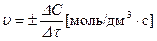
Розрізняють гомогенні (однорідні) та гетерогенні (у яких є поверхня поділу фаз) реакції. У хімічних реакціях вказують агрегатний стан речовин – твердий (т), рідкий (р), газуватий (г). Концентрації звичайно позначають у квадратних дужках або С, одиниці вимірювання – моль/дм3.
Кінетичне рівняння реакції (закон дії мас):
Для гомогенної реакції в загальному вигляді
а А(г) + b В(г) = с С(г) + d D(г)
υ пр = kпр · [А]а · [В]b
Для гетерогенної реакції концентрація твердої фази не входить у вираз для швидкості реакції:
а А(т) + b В(г) = с С(г) + d D(г)
υ пр = kпр · [В]b
Вплив температури на швидкість хімічної реакції визначається правилом Вант-Гоффа:
При підвищенні температури на 10 ºС швидкість будь-якої хімічної реакції збільшується в 2-3 рази. Число, яке показує, у скільки разів збільшується швидкість реакції при підвищенні температури на 10 ºС, називається температурним коефіцієнтом реакції γ.
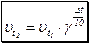
Хімічна рівновага - стан системи, коли швидкість прямої реакції дорівнює швидкості зворотної реакції. При цьому можна визначити константу хімічної рівноваги (Крівн.). Для гомогенної реакції в загальному вигляді
а А + в В ↔ с С + d D

Принцип Ле-Шательє: якщо змінити одну із умов, за яких система перебуває у рівновазі (температуру, тиск або концентрацію), то рівновага зміщується в напрямку тієї реакції, яка протидіє цій зміні.
Приклад 1. Записати кінетичні рівняння швидкості для прямої реакції:
а) N2(г) + 3Н2(г) = 2NН3(г)
б)CaCO3 (т) → СаО(т ) + СО2(г)
Розв’язoк:
а) υ пр. = kпр [N2]·[H2]3;
б) оскільки кальцій карбонат – тверда речовина, і концентрація її в процесі реакції не змінюється, вираз рівняння швидкості матиме вигляд:
υ пр. = kпр,
тобто швидкість даної реакції за певної температури є величиною сталою.
Приклад 2. Як зміниться швидкість прямої реакції
2СО(г) + О2(г) = 2СО2(г),
якщо об’єм, в якому відбувається реакція, збільшити вдвічі?
Розв’язок:
Згідно із кінетичним рівнянням швидкість υ прямої реакції до зміни об’єму дорівнює:
υ пр. = kпр [CO]2 [О2]
Якщо збільшити об’єм удвічі, то концентрація кожної із реагуючих речовин зменшиться вдвічі. При нових концентраціях швидкість прямої реакції (υ'):
υ'пр= kпр [1⁄2 СO]2 · [1/2 О2] = 1⁄8 kпр [СО]2[O2]
Отже, швидкість прямої реакції зменшиться у 8 разів.
Приклад 3. Як зміниться швидкість прямої реакції:
Fe2O3(т) + 3H2(г) → 2Fe(т) + 3H2O(г),
якщо початковий тиск у системі збільшити втричі?
Розв’язок:
До зміни тиску в системі швидкість реакції:
υ пр = kпр [H2]3
При збільшенні тиску втричі збільшиться концентрація реагуючих речовин втричі. При нових концентраціях швидкість реакції (υ '):
υ 'пр = kпр [3H2]3 = 27 kпр [H2]3.
Отже, швидкість реакції зросте у 27 разів.
Приклад 4. Розрахувати, у скільки разів збільшиться швидкість хімічної реакції, що проходить в газовій фазі, за умови збільшення температури від 30 ºС до 70 ºС. Температурний коефіцієнт реакції дорівнює 2.
Розв’язок:
Залежність швидкості реакції визначається за правилом Вант-Гоффа:


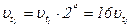
Отже, швидкість хімічної реакції збільшиться в 16 разів.
Приклад 5. Реакція розкладу пентахлориду фосфору перебігає за рівнянням:
РСl5(г) ↔ РСl3(г) + Сl2(г) – 92 кДж
Як треба змінити:
а) температуру;
б) тиск;
в) концентрацію реагентів,
щоб змістити рівновагу реакції в сторону розкладу РСl5 (вправо).
Розв’язок. Напрямок зміщення рівноваги реакції визначається за правилом Ле Шательє:
а) оскільки реакція розкладу РСl5 ендотермічна (- 92кДж), то для зміщення рівноваги в сторону прямої реакції (→) потрібно підвищити температуру – Т↑;
б) у зв’язку з тим, що пряма реакція веде до збільшення об’єму в системі (із однієї молекули газу утворюється дві газуваті молекули), для зміщення рівноваги вправо (→) треба зменшити тиск р↓;
в) змістити рівновагу вправо (→) можна як збільшенням концентрації РСl5 ([РСl5]↑), так і зменшенням концентрації РСl3 ([РСl3]↓) або Сl2 ([Сl2 ]↓).
|
|
Дата добавления: 2015-05-24; Просмотров: 5380; Нарушение авторских прав?; Мы поможем в написании вашей работы!