
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Етилен й ацетилен
|
|
|
|
Фізичні властивості етилену й ацетилену. Гази без кольору й запаху, мало розчинні у воді, трохи легші за повітря.
Одержання ненасичених вуглеводнів.
1) Ненасичені вуглеводні можна одержати дегідруванням насичених. Реакція йде в присутності каталізаторів (платини або нікелю) і при нагріванні. Залежно від ступеня дегідрування можна одержати алкени або алкіни, а також здійснити перехід від алкенів до алкінів:
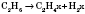
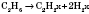
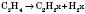
2) При крекінгу алканів виходить суміш алканів і алкенів, наприклад:

3) Ацетилен у промисловості й лабораторії одержують взаємодією кальцій карбіду з водою, реакція екзотермічна:
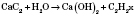
4) У промисловості ацетилен в основному одержують термічним розкладанням метану:

5) Дегідрогалогенування галогеналканів нагріванням зі спиртовим розчином лугу — лабораторний метод одержання ненасичених вуглеводнів:
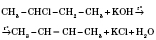
Приро́дний газ (рос. газ; англ. gas; нім. Gas n, Erdgas n) — суміш газів, що утворилася в надрах землі при анаеробному розкладанні органічних речовин. Як правило, це суміш газоподібних вуглеводнів (метану, етану, пропану, бутану тощо), що утворюється в земній корі та широко використовується як високоекономічне паливо на електростанціях, у чорній та кольоровій металургії, цементній та скляній промисловості, у процесі виробництва будматеріалів та для комунально-побутових потреб, а також як сировина для отримання багатьох органічних сполук.
Основну частину природного газу складає метан (CH4) — до 98%. До складу природного газу можуть також входити більш важкі вуглеводні:
· етан (C2H6),
· пропан (C3H8),
· Бутан (сполука) (C4H10)
— гомологи метану, а також інші невуглеводні речовини:
· водень (H2),
· сірководень (H2S),
· диоксид вуглецю (CO2),
· азот (N2),
· гелій (Не2).
Властивості природного газу [ред.]
Природний газ не має кольору і запаху. Щоб можна було визначити витік по запаху, до нього перед подачею споживачам додають одорант — речовину з різким специфічним запахом. Як одорант може використовуватись етилмеркаптан — C2H5SH або суміш природних меркаптанів — СПМ (C2H3P). У магістральних газопроводах транспортується неодоризований газ, оскільки одорант належить до агресивних речовин, що спричиняють корозію стінок труб.
Фізико-хімічні властивості, параметри яких характеризують газ (газоконденсат) за умов пластових тисків і температури:
· густина,
· в'язкість,
· вологовміст,
· розчинність,
· зворотна конденсація,
· критична температура і тиск,
· об'ємний коефіцієнт,
· коефіцієнт стисливості та ін.
Фізичні властивості [ред.]
· Орієнтовні фізичні характеристики:
· Густина: ρ = 0,7 кг/м³ (сухий газоподібний) або 400 кг/м³ рідкий
· Температура займання: t = 650 °C
· Теплота згоряння: 16 — 34 МДж/м³ (для газоподібного)
· Октанове число при використанні на двигунах згоряння: 120 — 130
Отруйні властивості природного газу [ред.]
Докладніше: Отруйні властивості природного газу
Природний газ створює удушаючу дію на організм людини. В атмосферному повітрі населених пунктів, у повітрі робочої зони і у воді водоймищ санітарно-побутового водокористування встановлюються гранично допустимі концентрації шкідливих речовин, які затверджуються Міністерством охорони здоров'я України.
Із газових компонентів природних і нафтових газів особливо токсичним є сірководень, його запах відчувається при вмісті в повітрі 0,0014-0,0023 мг/л. Сірководень — отрута, що викликає параліч органів дихання й серця. Концентрація сірководню 0,06 мг/л викликає головний біль. При концентраціях 1 мг/л і вище настають гостре отруєння і смерть.
Застосування [ред.]
Природний газ широко використовується в хімічній промисловості як вихідна сировина. Також використовується як пальне, для опалення житлових будинків, паливо для машин, електростанцій і ін. Сьогодні із понад 50 млн тонн водню, що виробляється у світі, половина отримується шляхом конверсії водяної пари із природним газом. Використання водню, як палива, є основою водневої енергетики.
КОЕФІЦІЄНТ НЕРІВНОМІРНОСТІ СПОЖИВАННЯ ГАЗУ — відношення середньої фактичної витрати газу за певний період (сезон, добу, годину) до середньої витрати за більший відповідний період (відповідно рік, місяць, доба).
Україна відноситься до енергодефіцитних країн, яка задовільняє свої потреби в енергетичних ресурсах за рахунок власного виробництва менше ніж на 50 % (у тому числі по споживанню імпортованого природного газу на душу населення займає перше місце в світі).[1]
На́фта [1](від грец. ναφθα; лат. petroleum, від грецької Πέτρα (камінь) латини: oleum (олія)), також земляна́ олі́я, теку́чка або кип'я́чка — горюча корисна копалина, складна суміш вуглеводнів різних класів з невеликою кількістю органічних кисневих, сірчистих і азотних сполук, що являє собою густу маслянисту рідину. Забарвлення в неї червоно-коричневе, буває жовто-зелене і чорне, іноді зустрічається безбарвна нафта.[2] Нафта має характерний запах, легша за воду, у воді нерозчинна.
Елементний склад, %: вуглець 80-88, водень 11-14,5, сірка 0,01-5, кисень 0,05-0,7, азот 0,01-0,6.
Не дуже давно нафта тільки спалювалася в топках. Після винаходу гасової лампи (1855 р.) з деякої частини нафти стали одержувати гас. Наприкінці минулого сторіччя бензин і газ, що отримували при виробленні гасу, вважалися шкідливими продуктами, що викликали вибухи і пожежі, а олії спалювалися разом з мазутом.
Сьогодні вся нафта, що добувається, піддається переробці для одержання багатьох різноманітних продуктів. При переробці нафти мають місце наступні основні процеси:
а) перегін;
б) термічний крекінг;
в) каталітичний крекінг;
г) піроліз;
д) коксування;
е) деструктивна гідрогенізація.
Більшість названих процесів протікає в присутності різних каталізаторів.
Підготовка нафти до переробки. Видобуток нафти супроводжується вилученням із природних підземних резервуарів значних кількостей газу, води, механічних домішок і солей. При надходженні на поверхню газ, розчинений у нафті, відокремлюють від неї за допомогою системи сепарації. Найбільш легкі компоненти вуглеводних газів відокремлюють від нафти в нафтових трапах, колонках і мірниках. Найважчі вуглеводні гази відокремлюють від нафти в газових сепараторах. У трапі також відбувається очищення газу від нафтового пилу. Відділення газу від нафти і пилу в трапі відбувається за рахунок зміни тиску і швидкості нафтового потоку, що рухається. Для поліпшення процесу сепарації суміш, що надходить у трап, розприскують, для чого в трапах установлюють ґрати, відбійники, тарілки й ін. пристосування. Для поділу продуктів фонтанування високого тиску (вище 20 атм.) застосовують східчасту сепарацію, при якій досягається грубе фракціонування газу і використовується пластовий тиск для транспорту газу. Відділена від газу нафта спрямовується в промислові резервуари, а звідти на нафтопереробні заводи.
При відділенні газу від нафти в трапах і інших пристроях відокремлюється й основна маса води і механічних домішок. Відділення домішок і води відбувається також при відстоюванні і збереженні нафти в промислових резервуарах.
Однак при подачі нафти на переробку в ній ще залишається деяка кількість води і механічних домішок, що також попадають у нафту при збереженні і транспортуванні. Наявність домішок у нафті погіршує показники процесу її переробки, приводить до зниження продуктивності, підвищення енергоємності процесу, засмічення і корозії апаратури і трубопроводів. Тому зневоднювання нафти і видалення з водою механічних домішок є обов'язковими стадіями переробки нафти.
Іноді вдається звільнитися від води невеликим підігрівом і відстоюванням нафти в резервуарах, але в більшості випадків бурові води із солями й іншими забрудненнями утворюють з нафтою стійкі емульсії, зруйнувати і відокремити які важко. Для руйнування стійких емульсій, застосовують центрифугування, добавки електролітів, колоїдних деемульгаторів та ін.
Нафту, яку переробляють шляхом перегону поділяють на фракції, які після відповідного очищення можуть бути використані як товарний продукт чи як використані як товарний продукт чи як сировина для подальшої більш глибокої переробки.
Перегоном нафти називають процес її термічного поділу на частини (фракції) без помітного розкладання вуглеводнів, що входять до складу нафти. Перегін оснований на властивості вуглеводнів що входять до складу нафти, виділяти пару визначеної пружності при даній температурі. При підвищенні температури нафти, що переганяється, пружність пари над нею зростає і коли вона досягає чи перевершує тиск навколишнього середовища (атмосфери) починається рух частинок пари в простір з меншим тиском.
Пару, яка виходить з нагрівального апарата, охолоджують і вона конденсується, створюючи розрідження і сприяючи відділенню наступних більш висококиплячих частин суміші, що переганяється.
Таким чином, при перегоні нафти виникає безупинне переміщення пари із простору, що нагрівається, в охолоджуване середовище, і це продовжується до повного перегону рідини.
Найчастіше нафту переганяють на наступні фракції: бензинову, що википає до 170-200 °C; гасову, що википає при 175-270 °C; газойлеву, що википає при 270-350 °С і залишок-мазут.
При перегоні нафти одержують також газ прямої гонки, що представляє собою важку частину попутних газів, що залишилися розчиненими в нафті. Як правило, вихід газу прямого перегонку невеликий.
Сьогодні застосовують високопродуктивні безперервнодіючі трубчасті перегінні установки, що відрізняються конструкцією печей, у яких відбуваються нагрівання нафти, чи конструкцією інших апаратів, що входять до складу установки.
У більшості випадків трубчаста безперервно діюча установка складається з трубчастої печі, насоса, що качає нафту через трубчасту піч під тиском 10 і більше атм. колони фракціонування, куди надходить перегріта нафта і де вона розділяється на необхідні фракції, що відбираються з колони на різній висоті, конденсатора, водовідбирача і пароперегрівача, що служить для перегріву пари.
Бензин з газами прямого перегонку відбирається у верхній частині колони і спрямовується на охолодження і конденсацію. Після відділення від нього води у відстійнику бензин збирають у проміжному резервуарі звідки насосом перекачують у сховище. Газ, що залишається після конденсації бензину, направляють у газгольдери.
Інші фракції також збирають по висоті колони і направляють у резервуари. Залишок, що невипарувався, (мазут) із дна колони спрямовується в приймач.
На трубчастих установках можна переганяти понад 2000 т нафти на добу.
Одержані в результаті перегонку нафти фракції використовують після відповідної обробки (очищення й ін.), як товарні види палива і мастил чи піддають вторинній переробці.
Застосування[ред.]
Нафта — найважливіше джерело рідкого палива, мастил, сировина для синтетичних матеріалів тощо. Нафта займає провідне місце в світовому паливно-енергетичному господарстві. Її частка в загальному споживанні енергоресурсів безперервно зростає: 3% в 1900 р., 5% перед Першою світовою війною 1914–1918 рр., 17,5% напередодні Другої світової війни 1939–1945 рр., 24% у 1950 р., 41,5% у 1972 р., 48% в 2004 р. У перспективі ця частка буде меншати внаслідок зростання застосування атомної і інших видів енергії, а також збільшення вартості видобутку.
Детонаційна стійкість є основним показником якості бензинів. Вона характеризує здатність бензину згорати в двигуні від іскри без детонації. Детонацією називається такий режим роботи двигуна, при якому частина палива самозаймається і в результаті тиск у двигуні наростає не плавно, а стрибками, порушуючи роботу двигуна. Мірою детонаційної стійкості є октанове число, яке вимірюється у сотому шкалою. За нуль шкали прийнята детонаційна стійкість н-гептану. За 100% прийнята детонаційна стійкість ізооктану, а точніше 2,2,4 - триметилпентана. Таким чином, ОЧ - показник детонаційної стійкості бензину, чисельно рівний процентному змісту ізооктану в еталонній суміші з н-гептаном, яка за детонаційної стійкості еквівалентнавипробуваному бензину.
ам’яне вугілля – один з видів викопного палива, перехідний стан від бурого вугілля до антрациту. Кам’яного вугілля розробляється більше, ніж будь-якого іншого, приблизно 2,5 мільярда тонн на рік, це приблизно близько 700 кг на кожного жителя нашої Землі. Кам’яне вугілля використовують для вироблення електроенергії на теплоелектростанціях, як паливо у приватних будинках, на фабриках і багато іншого. Кам’яне вугілля горить світиться полум’ям і має більш високу теплоту горіння, ніж бурий.
До складу кам’яного вугілля входить волога від 3% до 12%, також міститься до 32% летких займистих речовин.
У хімічний склад кам’яного вугілля входить:
· вуглець від 75% до 93% (залежно від сорту, місця розташування),
· водень від 4% до 6%,
· кисень від 3% до 19%
· азот до 2,7%
Кам’яне вугілля, як і нафта, не індивідуальна речовина. До його складу входять вільний вуглець (до 10%), органічні речовини, що містять Карбон, Гідроген, Оксиген, Сульфур, Нітроген, мінеральні речовини (вони залишаються у вигляді шлаку після спалювання вугілля).
Вам відомо, що вугілля використовується як паливо, але не меншого значення надається хімічній переробці вугілля з метою вилучення величезної кількості цінних речовин.
Унаслідок нагрівання до 1000 ◦С без доступу повітря вугілля перетворюється на кокс. Цей продукт на 96-98% складається з вуглецю. Основна галузь застосування – металургія.
Разом з коксом утворюються коксовий газ і кам’яновугільна смола, що є багатим джерелом різноманітних речовин,- з неї їх виділено близько 500. Перегонкою і хімічною обробкою кам’яновугільної смоли добувають ароматичні вуглеводні: толуол, нафталін, феноли, інші цінні речовини.
Кам’яновугільна смола і коксовий газ перероблюються на коксохімічних заводах.
У розвитку синтетичної органічної хімії кам’яновугільна смола відіграла особливу роль. Як джерело хімічних сполук кам’яне вугілля почало використовуватись раніше, ніж нафта і природний газ. На основі продуктів, виділених із кам’яновугільної смоли, виникли цілі галузі хімічної промисловості – виробництво синтетичних барвників, лікарських препаратів, засобів захисту рослин, вибухових речовин тощо.
Кам’яновугільна смола виявилася доступною сировиною для виробництва всіх цих продуктів, що уможливило їх багатотоннажне виробництво. Отже, кам’яне вугілля – цінна хімічна сировина, яку вигідніше переробляти, ніж спалювати.
Кам'яне вугілля використовується як технологічна, енерго-технологічна і енергетична сировина, при виробництві коксу і напівкоксу з отриманням великої кількості хімічних продуктів (нафталін, феноли, пек тощо), на основі яких одержують добрива, пластмаси, синтетичні волокна, лаки, фарби і т.і. Один з найбільш перспективних напрямів використання кам'яного вугілля – скраплення (зрідження) - гідрогенізація вугілля з отриманням рідкого палива. При переробці кам'яного вугілля отримують також активне вугілля, штучний графіт і т.д.; в промислових масштабах вилучається ванадій, германій і сірка; розроблені методи отримання галію, молібдену, цинку, свинцю. Існують різні схеми неенергетичного використання кам'яного вугілля на основі термохімічної, хімічної та іншої переробки з метою їх повного комплексного використання і забезпечення охорони довкілля. Для задоволення потреб економіки Україна щорічно використовує близько 100 млн.т вугілля, з яких майже 80 млн.т видобувається вітчизняними підприємствами.
Життя людини повсякденно пов’язане зі спалюванням горючих речовин у побуті, на транспорті, у промисловості. Крім користі застосування нафтопродуктів, вугілля і природного газу створює ряд проблем, негативних для розвитку цивілізації та загалом для виживання людства.
Тепловий баланс нашої планети підтримується завдяки тому, що діоксид карбону і вода, які містяться в атмосфері, поглинають енергію сонячного випромінювання (інфрачервону частину спектра), а потім пере випромінюють її. Таким чином на планеті зберігається тепло.
Поглинання і випромінювання енергії діоксидом карбону та іншими речовинами спричинює парниковий ефект. Отже, можна сказати, що ми живемо в умовах парникового ефекту, і це відповідає нормальному станові атмосфери, комфорту для нас. Проте посилення цього ефекту може мати згубні наслідки, а саме – глобальне підвищення температури й у зв’язку з цим – зміну клімату.
До цього може призвести підвищення концентрації вуглекислого газу за рахунок спалювання горючих речовин. Протягом останніх 100 років у результаті техногенної діяльності людини вміст вуглекислого газу в атмосфері невпинно зростає.
Крім парникового ефекту в результаті переробки і використання горючих корисних копалин атмосфера забруднюється шкідливими речовинами, такими як оксид карбону (ІІ) СО (від невпинного згоряння пального у двигунах), оксид сульфуру (IV) SO2 (утворюється з сірки, що міститься у вугіллі і бензині), метан СН4 (витік газу), сірководень Н2S (виділяється під час перегонки нафти), оксиди нітрогену NO, NO2 (під час високотемпературного горіння) та ін.
Усі ц речовини спричинюють фотохімічних смог[1], кислотні дощі тощо.
Фотохімічний смог утворюється в результаті реакцій, що відбуваються під впливом сонячного світла (фотохімічні реакції). При цьому, крім наявних у повітрі зарубників, додатково утворюється діоксид нітрогену та озон. Останній реагує з вуглеводнями, що виділяються в повітря від неповного згоряння пального. У результаті утворюються сполуки, безпечні для здоров’я людей і шкідливі для довкілля.
Фотохімічний смог вперше спостерігався в Лос-Анджелесі, де багато сонця та автомобілів.
Крім цього, під час згоряння пального утворюється дим, в якому містяться дрібні частинки вуглецю і твердих вуглеводнів, що не згоріли, а також сполуки Кадмію, Плюмбуму, Меркурію та інших елементів, надзвичайно шкідливих для здоров’я.
Яким чином можна позбутися шкідливих забрудників, що утворюються в результаті використання палива і пального?
По-перше, можна ощадливо використовувати ці продукти, тим самим зменшуючи кількість шкідливих викидів. По-друге, можна вилучати з палива сірку ще до його використання. По-третє, створювати технологічні умови повного згоряння вугілля в котельнях, на теплоелектростанціях та бензину у двигунах автомобілів. По-четверте, можна уловлювати відходи після згоряння палива за допомогою фільтрів. По-п’яте, можна замінити джерела енергії: замість енергії палива використовувати енергію сонця, вітру, води, ядерну та геотермальну енергію.
Переваги природного і попутного нафтового газу - Дешевий вид палива - Володіє високою теплотворною здатністю (теплота згоряння 1м3 газу 54400 кДж) - Легко транспортується по газопроводах - Екологічно чистий вид палива.
Органічні речовини в живій природі були першими об’єктами дослідження науки, що згодом дістала назву органічна хімія. Уперше це поняття ввів шведський науковець Й. Я. Берцеліус (мал. 1.3). У своєму підручнику з хімії (1827) вія наголошував, що у живій природі елементи підпорядковані іншим законам, ніж у неживій, тож органічні речовини не можуть утворюватися під впливом звичайних фізичних і хімічних сил, для цього потрібна особлива «життєва сила*. Тому органічну хімію Й. Я. Берцеліус визначив, як хімію рослинних і тваринних речовин. Аби довести обмеженість цього твердження, досить пригадати відомі вам з основної школи перші синтези органічних сполук1 «in vitro*. До того ж, поглянувши навколо, ви пересвідчитеся: чи не на кожному кроці ми використовуємо синтетичні органічні речовини, яких у живій природі немає (наведіть кілька прикладів).
Однак жива природа з давніх-давен була й залишається невичерпним джерелом органічних речовин, важливість яких неможливо переоцінити. Олії та тваринні жири, різноманітні смолисті, клейкі й цукристі речовини, крохмаль, віск, духмяні есенції, барвники рослинного й тваринного походження ще в другій половині І ст. описав в енциклопедичному творі «Природнича історія* римлянин Гай Пліній-Секунд (назвіть органічні речовини живої природи, які ви вже вивчали на уроках хімії і біології).
До сьогодні людство використовує органічні речовини, вироблені живими організмами, аби задовольнити матеріальні потреби, передусім - у харчових продуктах, зручному одязі, комфортному житлі, теплі, дотриманні гігієни, збереженні здоров’я тощо. Доведемо це на прикладі целюлози (про цей біополімер - головну складову клітинних стінок рослин - ви дізналися в 9-му класі). Незважаючи на те, що організм людини практично не засвоює целюлозу, вона відіграє важливу роль у харчуванні і підтриманні здоров’я. Світовою медичною спільнотою визнано, що нестача клітковини в раціоні є однією з найважливіших причин погіршення здоров’я і, як наслідок, якості життя. Люди, у харчуванні яких достатньо рослинних продуктів і клітковини, набагато менш схильні до таких захворювань, як рак кишечнику, а також надмірна маса тіла й ожиріння.
Водночас саме целюлоза, що міститься в рослинах, є основною поживною речовиною у складі корму для багатьох сільськогосподарських тварин, яких використовують для одержання м’яса, молока, жиру, яєць, вовни, щетини, шкіри, кісток, пуху й пір’я (назвіть органічні речовини в складі цих продуктів).
Лляний і бавовняний одяг має високі гігієнічні властивості і привабливий зовнішній вигляд (мал. 5.1).
Вата — складова будь-якої аптечки невідкладної допомоги. Усі ці речі виготовлено з волокон целюлози.
Деревина, головною складовою якої також є целюлоза, — чи не найдавніший вид палива, що й досі не втратив своєї актуальності й привабливості.
Пелети ~ гранули з відходів деревообробного виробництва, подрібненої соломи, лушпиння соняшнику тощо (мал. 5.2). Теплотворна здатність пелет щонайменше у 1,5 раза більша, ніж у деревини, і порівнянна з вугіллям.
Тож недарма в Європі їх вважають паливом для сталого майбуття.
Пригадайте: за визначенням Комісії OOH зі сталого розвитку його мета - задовольняти потреби сучасного суспільства, не піддаючи небезпеці можливість майбутніх поколінь задовольняти свої потреби.
Задоволення духовних потреб людини, зумовлених суспільним існуванням, також тісно пов’язане з використанням целюлози. Зокрема, винайдення паперу - важлива історична віха в культурному розвитку людства. Це відразу розширило застосування писемності, яка до цього часу залишалася надбанням лише правителів, їхніх наближених і вузького кола науковців. Хоча наразі листування, читання, спілкування, навчання з використанням паперу поступається місцем електронним книжкам, пошті, зв’язку на основі комп’ютерних технологій, але папір як історичний, суспільний, мистецький, технологічний феномен викликає щире захоплення.
Дізнайтеся більше... Хто не чув про орігамі (мал. 5.3) - мистецтво складання паперу, започатковане у храмових обрядах Сходу. Воно дотепер дарує радість і красу мільйонам людей в усьому світі. Показово, що в XXl столітті техніка орігамі набула зовсім нового змісту. Йдеться про унікальні властивості молекул ДНК (пригадайте: її склад, будову й біологічні функції ви вивчали на уроках хімії в основній школі і біології у 10-му класі).
Пол Ротемунд (Каліфорнійський технологічний інститут, Пасадена, США) 2006 року оприлюднив новий спосіб збирання складних двовимірних наноструктур з молекул ДНК, що ґрунтується на здатності цієї речовини до самоорганізації. Дослідники використали природне «стремління* молекул ДНК до формування подвійних спіралей і скручування (згинання) ділянок ланцюга. Причиною цього є різноманітні взаємодії між фрагментами молекул: утворення водневих зв’язків, електростатична взаємодія заряджених функціональних груп тощо. Саме сили міжмолекулярної взаємодії змушують довгий ланцюг ДНК скластися.
Наприкінці 2008 р. міжнародна наукова група, очолювана Йоргеном Кьємсом з Інституту молекулярної біології Університету Opxyca і Данського
Національного центру ДНК-нано - технологій, створила тривимірні «скульптури» з ДНК, що вирізняються жорсткістю стінок і наявністю рухомих деталей. Такі ДНК - скриньки (мал. 5.4) із замками в перспективі можуть бути використані для прицільного транспортування лікарських засобів всередині організму, створення ДНК-комп’ю - тера, що сам себе збирає. Це яскравий приклад єдності складу, будови та зумовлених ними властивостей і біологічних функцій речовини.
Про головне
Жива природа — невичерпне джерело органічних речовин.
Хімія живого — один зі стратегічних напрямів розвитку сучасної хімічної науки.
40 і 41
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2289; Нарушение авторских прав?; Мы поможем в написании вашей работы!