
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розв’язання. Відзначимо, що швидкість реакції збільшується не внаслідок зростання кількості зіткнень, а внаслідок збільшення кількості активних молекул
|
|
|
|
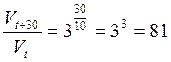 ×
×
Відзначимо, що швидкість реакції збільшується не внаслідок зростання кількості зіткнень, а внаслідок збільшення кількості активних молекул.
У переважній більшості хімічні реакції оборотні, тобто перебігає не тільки пряма реакція (®) з утворенням продуктів, але і зворотна () – взаємодія продуктів реакції з утворенням вихідних речовин. При написанні рівнянь оборотних реакцій замість знака рівності використовують знак оборотності (Û, або  ). Швидкість прямої реакції з часом зменшується, тому що зменшуються концентрації вихідних речовин; а зворотної – збільшується, тому що збільшуються концентрації продуктів. Нарешті швидкості обох реакцій зрівнюються і система переходить у стан хімічної рівноваги. Після цього кількісні зміни у системі зникають: зменшення концентрацій вихідних речовин і збільшення концентрацій продуктів реакції більше не відбувається.
). Швидкість прямої реакції з часом зменшується, тому що зменшуються концентрації вихідних речовин; а зворотної – збільшується, тому що збільшуються концентрації продуктів. Нарешті швидкості обох реакцій зрівнюються і система переходить у стан хімічної рівноваги. Після цього кількісні зміни у системі зникають: зменшення концентрацій вихідних речовин і збільшення концентрацій продуктів реакції більше не відбувається.
Цей стан системи кількісно характеризується константою хімічної рівноваги K, або K р. Для наведеної вище реакції вираз константи рівноваги має вигляд:
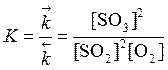 ,
,
де [ Хі ] - рівноважні (сталі) концентрації речовин. Отже, K дорівнює частці від ділення добутку рівноважних концентрацій продуктів реакції, взятих у степенях їх стехіометричних коефіцієнтів, на аналогічний добуток для вихідних речовин цієї ж реакції. Чим більше значення має K, тим більшою мірою відбувається прямий процес, і навпаки. K залежить тільки від природи реагуючих речовин і температури.
Якщо зовнішні умови не змінюються, стан рівноваги зберігається як завгодно довго. Коли внаслідок зміни цих умов рівність швидкостей порушується, відбувається зміщення хімічної рівноваги в один із боків. Для першого прикладу в цьому розділі при підвищенні тиску в системі швидкість прямої реакції зросла у 8 разів, а зворотної – тільки у 4 рази. Це означає, що хімічна рівновага змістилась вправо, тобто в бік утворення продуктів реакції.
Характер впливу зміни умов можна передбачити без будь-якого розрахунку на основі принципу Ле Шательє: зміна умов динамічної рівноваги (температури, концентрації, тиску) зумовлює переважний перебіг того з двох протилежних процесів, який протидіє цій зміні.
Так, підвищення тиску зумовлює переважний перебіг процесу, внаслідок якого знижується тиск газу. Останній пропорційний кількості молів газоподібних речовин, тому в наведеному прикладі рівновага зміщується вправо, що відповідає розрахункам. Але зміна тиску не впливає на стан рівноваги реакцій, у ході яких не змінюється кількість молів газів.
При підвищенні температури переважно відбувається процес, який сприяє охолодженню системи, тобто рівновага зміщується у бік ендотермічної реакції, і навпаки. У нашому випадку пряма реакція є екзотермічною, тому підвищення температури буде зміщати рівновагу вліво, тобто у бік зворотної реакції.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 348; Нарушение авторских прав?; Мы поможем в написании вашей работы!