
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. За станом (поведінкою) у розчинах речовини поділяються на неелектроліти й електроліти
|
|
|
|
За станом (поведінкою) у розчинах речовини поділяються на неелектроліти й електроліти. Неелектроліти – речовини, які існують у розчині тільки у вигляді молекул. Електроліти – речовини, які дисоціюють (розпадаються) у розчині на іони.
Кількісною мірою дисоціації електроліту є ступінь дисоціації, a:
a =  ; 0< a
; 0< a  1, або 0 < a
1, або 0 < a  100%.
100%.
До сильних електролітів, що дисоціюють повністю (a @ 1) відносяться луги, тобто розчинні у воді основи лужних і лужноземельних металів, сильні кислоти (HCl, HBr, HI, H2SO4, HNO3 та деякі інші), а також розчинні у воді солі (див. додаток, табл. 5).
У рівняннях процесів електролітичної дисоціації сильних електролітів прийнято писати знак рівності, слабких – знак оборотності (Û, або  ). Перший знак означає, що відповідна речовина у розчині існує повністю у вигляді іонів (молекули майже відсутні); другий знак означає, що встановлюється рівновага, яка характеризується сталими концентраціями як молекул (їх більшість), так і іонів. Наприклад:
). Перший знак означає, що відповідна речовина у розчині існує повністю у вигляді іонів (молекули майже відсутні); другий знак означає, що встановлюється рівновага, яка характеризується сталими концентраціями як молекул (їх більшість), так і іонів. Наприклад:
NaOH = Na+ + OH-;
HNO3 = H+ + NO32-;
NH4OH Û NH4+ + OH+;
H2S Û H+ + HS- - перший ступінь,
HS- Û H+ + S2- - другий ступінь.
Як було сказано раніше, будь-який оборотний процес (також і процес дисоціації) у стані рівноваги характеризується константою рівноваги, а в даному випадку – константоюелектролітичної дисоціації, K Д, наприклад:
K Д(NH4OH) =  << 1;
<< 1;
K Д1(H2S) =  ,
,
K Д2(H2S) =  ; K Д2 << K Д1.
; K Д2 << K Д1.
Чим слабший електроліт, тим менше значення його K Д.
Для слабких одноосновних кислот і однокислотних основ маємо:
С дис.(кисл.) = [H+] і С дис.(осн.) = [OH-],
тому a = 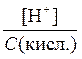 і a =
і a = 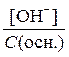 .
.
При розв’язанні задач цього розділу потрібно пам’ятати закон розбавлення, згідно з яким чим більше розбавлений розчин, тим більший ступінь його дисоціації:
K Д» С a2.
Кислотність розчинів вимірюють концентрацією іонів Гідрогену [H+] або значенням водневого показника рН:
pН = - lg[H+].
Якщо [H+] = 1×10-7 моль/л, рН = 7, то маємо нейтральне середовище,
[H+] > 1×10-7 моль/л, pH < 7 - кисле,
[H+] < 1×10-7 моль/л, pH > 7 - лужне.
Для розбавлених розчинів: рН + рОН = 14.
Приклад. Розрахувати рН і рОН розчину слабкої одноосновної кислоти та константу її дисоціації, якщо концентрація розчину дорівнює 0,005 моль/л, а ступінь її дисоціації в цьому розчині a = 20%.
Розв’язання. Для слабкої одноосновної кислоти
[H+] = a С (кисл.) = 0,2 × 0,005 = 0,01 моль/л).
Отже, pН = - lg[H+] = - lg(1×10-2) = 2, тоді рОН = 14 –2 = 12.
Константа дисоціації дорівнює: K Д» С a2 = 0,005 × 0,22 = 2 × 10-4.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 349; Нарушение авторских прав?; Мы поможем в написании вашей работы!