
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. При вивченні цього розділу курсу необхідно добре розуміти основні поняття
|
|
|
|
При вивченні цього розділу курсу необхідно добре розуміти основні поняття. Так, окисник – це атом, що приймає електрони у процесі реакції. При цьому ступінь окиснення його зменшується і він відновлюється, перетворюючись у продукт відновлення. Наприклад,
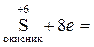
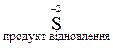 .
.
Відновник – це атом, що віддає електрони в процесі реакції. Ступінь окиснення атома при цьому збільшується і атом окислюється, перетворюючись у продукт окиснення. Наприклад,
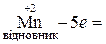
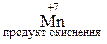 .
.
Атоми хімічних елементів, що знаходяться у максимальному ступені окиснення, можуть бути тільки окисниками:

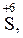
 ….
….
Атоми хімічних елементів, що знаходяться у мінімальному ступені окиснення, можуть бути тільки відновниками:
 ,
,  ,
,  ,
,  ,
, 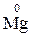 ,
, 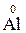 ,….
,….
Атоми елементів, що знаходяться у проміжному ступені окиснення, в залежності від умов можуть грати дві ролі – як окисника, так і відновника:
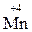 ,
,  ,
, 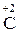 ,
, 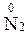 ,.…
,.…
Коефіцієнти у рівняннях окисно-відновних реакцій проставляють на основі методу електронного балансу: кількість відданих і прийнятих електронів у процесі реакції має бути однаковою.
Приклад. Розрахуйте ступені окиснення елементів у реакції
K2Cr2O7 + H2S + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O.
Знайдіть атоми окисника та відновника у формулах відповідних речовин. На основі методу електронного балансу розставте коефіцієнти у цій реакції.
Розв’язання. 1. Визначаємо ступені окиснення всіх елементів у рівнянні. Незмінні значення ступеня окиснення мають Гідроген (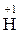 ), Оксиген (
), Оксиген (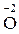 ), Калій (
), Калій ( ). Заряд сульфат-аніона SO
). Заряд сульфат-аніона SO 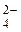 дорівнює -2. Ступінь окиснення Сульфуру в H2SO4 та її солях - Cr2(SO4)3 і K2SO4 - дорівнює +6 і не змінюється у ході реакції. Відзначимо, що ступінь окиснення елемента у простій речовині дорівнює нулю. У наведеному прикладі це −
дорівнює -2. Ступінь окиснення Сульфуру в H2SO4 та її солях - Cr2(SO4)3 і K2SO4 - дорівнює +6 і не змінюється у ході реакції. Відзначимо, що ступінь окиснення елемента у простій речовині дорівнює нулю. У наведеному прикладі це −  у правій частині рівняння. Розраховуємо ступінь окиснення Хрому та Сульфуру у вихідних речовинах і продуктах реакції, знаючи, що сума ступенів окиснення всіх елементів у молекулі дорівнює нулю:
у правій частині рівняння. Розраховуємо ступінь окиснення Хрому та Сульфуру у вихідних речовинах і продуктах реакції, знаючи, що сума ступенів окиснення всіх елементів у молекулі дорівнює нулю:
Для K2Cr2O7: Для Cr2(SO4)3:
2(+1) + 2 х + 7(-2) = 0 2 х + 3(-2) = 0
х = +6; тобто Cr+6 x = +3; тобто Cr+3
Для S: Для H2S:
x = 0; тобто S0 2(+1) + х = 0;
х = -2; тобто S-2.
2. Записуємо елементи, що змінюють ступені окиснення внаслідок перебігу реакції, а також напівреакції окиснення та відновлення:
S-2 - 2 е = S0; ´3;
2Cr+6 + 6 е = 2Cr+3; ´1.
Таким чином, S-2 - відновник, і він окиснюється; Cr+6 - окисник, і він відновлюється. Взагалі, електронні напівреакції окиснення та відновлення необхідні при розставленні коефіцієнтів методом електронного балансу.
3. Для того, щоб кількості відданих та прийнятих електронів були рівними, множимо першу напівреакцію на 3, а другу – на 1 (див. пункт 2). Це основні коефіцієнти, які ставимо у рівняння перед вихідними речовинами (1K2 Cr 2O7 і 3H2 S) та продуктами реакції (1 Cr 2(SO4)3 і 3 S).
4. Зрівнюємо кількості катіонів металів (Калію) у відповідних речовинах: 1 K 2Cr2O7 зліва і 1 K 2SO4 справа (одиницю зазвичай не пишуть).
5. Зрівнюємо кількості аніонів кислотних залишків (сульфат-іонів): у правій частині маємо чотири іони SO 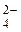 , тому перед Н2SO4 зліва також ставимо 4.
, тому перед Н2SO4 зліва також ставимо 4.
6. У передостанню чергу зрівнюємо кількості катіонів Гідрогену: в лівій частині рівняння маємо 14Н+ (3H2S і 4Н2SO4), тому в правій частині перед H2O ставимо 7.
7. В останню чергу перераховуємо кількості атомів Оксигену. В обох частинах рівняння їх по 23. Рівність кількостей цих атомів (їх спеціально не зрівнювали) означає, що коефіцієнти розставлено вірно:
K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O.
Якщо у хімічні реакції вступають метали, вони завжди є відновниками і окислюються. Атомом-окисником у реакціях з водою, розчинами лугів і кислотами-неокисниками (HCl, H2SO4(розв.), H3PO4, CH3COOH тощо) виступає катіон Гідрогену Н+:
Ме0 - ze = Me z +
2Н+ + 2 e = H2.
Продукт відновлення у цьому випадку - газоподібний водень, продукти окиснення – гідроксиди металів, гідроксокомплекси або солі металів. При реакціях металів з водними розчинами кислот-окисників, таких, як H2SO4(конц.), НNO3(конц.), НNO3(розв.), потрібно пам’ятати, що атомами-окисниками у цих випадках виступають атоми кислотоутворюючих елементів -  та
та  Продуктами окиснення виступають зазвичай солі металів. Склад продуктів відновлення залежить від активності металів (див. ряд стандартних електродних потенціалів металів, додаток, табл.4). Так, дуже активні метали (Li – Mg) відновлюють концентровану сульфатну кислоту до Н2S; активні (Ве – Cr) – до S; малоактивні (Fe – Hg) – до SO2. Подібним чином діє розведена нітратна кислота. Відповідними продуктами відновлення HNO3(розв.) будуть: NН3 (точніше NH4NO3) або N2 (для Li – Mg); N2O (для Ве – Cr); NO (для Fe – Hg). Концентрована нітратна кислота незалежно від активності металу відновлюється з утворенням NO2.
Продуктами окиснення виступають зазвичай солі металів. Склад продуктів відновлення залежить від активності металів (див. ряд стандартних електродних потенціалів металів, додаток, табл.4). Так, дуже активні метали (Li – Mg) відновлюють концентровану сульфатну кислоту до Н2S; активні (Ве – Cr) – до S; малоактивні (Fe – Hg) – до SO2. Подібним чином діє розведена нітратна кислота. Відповідними продуктами відновлення HNO3(розв.) будуть: NН3 (точніше NH4NO3) або N2 (для Li – Mg); N2O (для Ве – Cr); NO (для Fe – Hg). Концентрована нітратна кислота незалежно від активності металу відновлюється з утворенням NO2.
Задачі
а). Визначивши ступені окиснення елементів, укажіть окисник і відновник. Методом електронного балансу розставте коефіцієнти в окисно-відновній реакції.
б). Напишіть рівняння взаємодії наведених в умові металів з водою та водними розчинами кислот, лугів, солей. Розставте коефіцієнти методом електронного балансу.
1. а) KMnO4 + SnCl2 + HCl ® MnCl2 + SnCl4 + KCl + H2O
б) Mg, Cu з H2SO4 (розв.), H2SO4 (конц.)
2. а) KMnO4 + H2S + H2SO4 ® MnSO4 + S + K2SO4 + H2O
б) Hg, Al з NaOH, HNO3 (розв.)
3. а) K2Cr2O7 + HI + H2SO4 ® Cr2(SO4)3 + I2 + H2O
б) Zn, Fe з H2SO4 (розв.), HNO3 (розв.)
4. а) Na3[Cr(OH)6] + H2O2  Na2CrO4 + H2O + NaOH
Na2CrO4 + H2O + NaOH
б) Ag, Ca з H2SO4 (конц.), HNO3 (конц.)
5. а) KMnO4 + Na2SO3 + H2O ® MnO2 + Na2SO4 + KOH
б) Be, Cd з FeSO4, KOH, HNO3 (розв.)
6. а) K2Cr2O7 + Zn + H2SO4 ® Cr2(SO4)3 + ZnSO4 + K2SO4 + H2O
б) Ba, Ni з H2O (t°), H2SO4 (розв.), H2SO4 (конц.) (t°)
7. а) KMnO4 + KI + H2SO4 ® MnSO4 + I2 + K2SO4 + H2O
б) Pb, Cr з NaOH, HNO3 (розв.)
8. а) Na2CrO4 + Na2S + H2O ® Na[Cr(OH)4(H2O)2] + S + NaOH
б) Hg, Ca з H2SO4 (конц.), HNO3 (конц.)
9. а) K2Cr2O7 + Na2SO3 + H2SO4 ® Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O
б) Al, Co з HCl, HNO3 (розв.)
10. а) KMnO4 + KBr + H2SO4 ® MnSO4 + Br2 + K2SO4 + H2O
б) Mg, Sn з Ni(NO3)2, H2SO4 (конц.), NaOH
11. а) KMnO4 + NH3 + KOH ® K2MnO4 + KNO3 + H2O
б) Mn, Cu з H2SO4 (розв.), HNO3 (розв.)
12. а) KMnO4 + FeCl2 + HCl ® MnCl2 + FeCl3 + KCl + H2O
б) K, Ti з H2O, H2SO4 (конц.), HNO3 (розв.)
13. а) K2Cr2O7 + HCl ® CrCl3 + Cl2 + KCl + H2O
б) Ag, Zn з CuSO4, H2SO4 (конц.), KOH
14. а) KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
б) Sn, Be з HNO3 (конц.), HNO3 (розв.)
15. а) KMnO4 + NaNO2 + H2O ® MnO2 + NaNO3 + KOH
б) Fe, Ca з H2O (t°), H2SO4 (розв.), H2SO4 (конц.) (t°)
16. а) K2Cr2O7 + SnCl2 + HCl ® CrCl3 + SnCl4 + KCl + H2O
б) Cu, Al з KOH, H2SO4 (розв.), H2SO4 (конц.) (t°)
17. а) KI + KNO2 + H2SO4 ® I2 + N2 + K2SO4 + H2O
б) Mn, Hg з HNO3 (конц.), HNO3 (розв.)
18. а) KMnO4 + H2O2 + H2SO4 ® MnSO4 + O2 +K2SO4 + H2O
б) Pb, Ba з CdSO4, HCl, HNO3 (розв.)
19. а) CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O
б) Na, Co з H2O, HCl (конц.), H2SO4 (конц.) (t°)
20. а) NaBrO3 + NaBr + H2SO4 ® Br2 + Na2SO4 + H2O
б) Cr, Ni з Co(NO3)2, KOH, HNO3 (розв.)
21. а) KClO3 + FeSO4 + H2SO4 ® KCl + Fe2(SO4)3 + H2O
б) Ca, Sn з ZnSO4, KOH, HNO3 (розв.)
22. а) KClO4 + Al + H2SO4 ® KCl + Al2(SO4)3 + H2O
б) Fe, Be з NaOH, HNO3 (розв.), H2SO4 (конц.) (t°)
23. а) AsH3 + AgNO3 + H2O ® H3AsO4 + Ag + HNO3
б) Pb, Zn з H2SO4 (конц.), HNO3 (конц.), CoSO4
24. а) (NH4)2SO4 + HNO3 ® N2 + H2SO4 + H2O
б) Mg, Ag з CuCl2, H2SO4 (розв.), HNO3 (розв.)
25. а) MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O
б) Ni, Cr з KOH, H2SO4 (розв.), H2SO4 (конц.)
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 380; Нарушение авторских прав?; Мы поможем в написании вашей работы!