
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. Корозія, тобто процес руйнування поверхні металевих виробів у результаті самодовільної фізичної та хімічної взаємодії з навколишнім середовищем
|
|
|
|
Корозія, тобто процес руйнування поверхні металевих виробів у результаті самодовільної фізичної та хімічної взаємодії з навколишнім середовищем, дуже часто має електрохімічний характер.
Якщо два різні метали перебувають у контакті (покриття, клепка, сплав, тощо), то виконуються всі три умови для виникнення та роботи гальванічного елемента: дві різні електрохімічні системи, замкнутість зовнішнього та внутрішнього кіл. Однак утворений гальванічний елемент суттєво відрізняється від звичайного як схемою, так і електродними процесами. Замість двох спеціально підібраних електролітів (розчини солей відповідних металів) наявний лише один – електроліт корозійного середовища, тобто електроліт середовища експлуатації виробу. Це може бути вологе повітря, яке містить кислі гази - СО2, SO2, H2S - або не містіть їх, а також кислі чи нейтральні водні розчини, які не містять кисню.
Первинний процес на аноді у таких елементах не відрізняється від процесу в звичайному гальванічному елементі – відбувається окиснення металу з меншим значенням електродного потенціалу, тобто його корозія.
Наприклад, у випадку оцинкованого заліза при механічному порушенні цілісності покриття починає кородувати цинк (анодне покриття) як метал з меншим значенням електродного потенціалу:
А(-): Zn0 - 2 e = Zn2+.
На катоді (у нашому випадку це залізо) із електроліту корозійного середовища має відновлюватись речовина з найбільшим потенціалом. Це може бути кисень повітря, іони Гідрогену кислот або води. При цьому потрібно пам’ятати що:
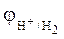 = - 0,059рН
= - 0,059рН
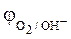 = 1,23 - 0,059рН.
= 1,23 - 0,059рН.
Потенціали цих окисників для різних за кислотністю середовищ такі:
| рН | |||
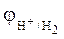 , В , В
| -0,41 | -0,82 | |
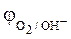 , В , В
| 1,23 | +0,82 | +0,41 |
Для наведеного прикладу катодні процеси можуть бути:
К(+): O2 + 4 e + 2H2O = 4OH- - у вологому середовищі,
К(+): O2 + 4 e + 4Н+ = 2Н2О - у кислому середовищі, яке містить повітря,
К(+): 2Н+ + 2 е = H2 - у кислому середовищі без кисню або без повітря,
К(+): 2H2O + 2 е = H2 + 2OH- - у нейтральному середовищі без кисню або без повітря.
Загальна схема корозійного гальванічного елемента (т.з. корозійної пари):
Ме анод | електроліт | Ме катод.
Схема корозійної пари для оцинкованого заліза у кислому середовищі, яке містить повітря:
Zn | H2O, O2, H+ | Fe.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 369; Нарушение авторских прав?; Мы поможем в написании вашей работы!