
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна кінетика. Мета роботи – вивчити залежність швидкості реакції від концентрації реагуючих речовин на прикладі реакції
|
|
|
|
Лабораторна робота №3
Мета роботи – вивчити залежність швидкості реакції від концентрації реагуючих речовин на прикладі реакції, яка перебігає у розчині між тіосульфатом натрію та сульфатною кислотою:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S¯.
Про швидкість реакції роблять висновок за величиною, зворотною до часу, який пройшов з моменту зливання розчинів до появи в усіх дослідах однакового помутніння внаслідок утворення сірки.
Порядок виконання роботи
1. Отримайте у викладача завдання: об’єм розчину тіосульфату натрію (а), об’єм води (b), об’єм розчину сульфатної кислоти (с).
2. Налийте з першої бюретки у три пронумеровані склянки зазначені у Вашому варіанті об’єми тіосульфату натрію з концентрацією С (Na2S2O3) = 0,1 моль/л. З другої бюретки додайте до кожної склянки відповідний об’єм дистильованої води.
3. У кожну склянку прилийте зазначений у варіанті об’єм розчину сульфатної кислоти з концентрацією С (H2SO4) = 1 моль/л, відмірюючи його циліндром. Відзначте час з моменту зливання розчинів до моменту появи помутніння.
Обробка результатів
1. Розрахуйте концентрацію тіосульфату натрію та сульфатної кислоти у кожній склянці:
С (Na2S2O3) 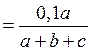 ; С (H2SO4)
; С (H2SO4)  .
.
2. Розрахуйте відносну швидкість реакції для кожної склянки:
v = 100/t, с-1.
3. Побудуйте графік залежності відносної швидкості реакції від концентрації Na2S2O3, відкладаючи на осі абсцис концентрацію тіосульфату натрію, а на осі ординат – відносну швидкість реакції.
4. Запишіть математичний вираз закону діючих мас для досліджуваного процесу та розрахуйте умовну константу швидкості реакції. Чи залежить константа швидкості реакції від концентрації реагуючих речовин? Занесіть результати у таблицю.
| № склянки | V, мл | С (Na2S2O3),моль/л | Час до початку помутніння | Відносна швидкість 100/t, с-1 | Умовна константа швидкості, k | ||
| Na2S2O3, а | Н2О, b | H2SO4, с | |||||
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 326; Нарушение авторских прав?; Мы поможем в написании вашей работы!