
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. Електроліз – це сукупність окисно-відновних процесів, які відбуваються на електродах при проходженні постійного електричного струму крізь розчин або розплав
|
|
|
|
Електроліз – це сукупність окисно-відновних процесів, які відбуваються на електродах при проходженні постійного електричного струму крізь розчин або розплав електроліту.
Мінімальна напруга, яку потрібно прикласти до електродів для забезпечення процесу електролізу, називається напругою розкладання (електролізу), U розкл., В. Вона дорівнює різниці потенціалів між анодом і катодом і завжди має позитивне значення:
U розкл. =  -
- 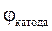 > 0.
> 0.
Відзначимо, що у формулі напруги розкладання  має мінімальне з можливих значень,
має мінімальне з можливих значень, 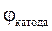 - максимальне.
- максимальне.
На катоді під час електролізу, як і у гальванічному елементі, перебігає процес відновлення. Відновлюватись можуть позитивно заряджені іони (катіони) Ме z+, Н+ або іони Гідрогену води (Н +-ОН). Таким чином, при електролізі катод приєднується до негативного полюса джерела електричного струму.
Враховуючи, що потенціал водневого електрода у залежності від кислотності розчину та перенапруги виділення водню може змінюватись у межах від –1,6 до –0,41 В, можна зробити такі висновки:
1) якщо потенціал металу менший за -1,6 В, на катоді відновлюється Гідроген води і внаслідок перебігу реакції cередовище стає лужним:
К(-): 2H2O + 2 е = H2 + 2OH-;
2) якщо потенціал металу більший за -0,41 В, відновлюються іони металу:
К(-):Ме z+ + ze = Me0;
3) якщо потенціал металу лежить у межах від -1,6 до -0,41 В, відновлюються одночасно іони металу та молекули води, хоча при певних змінах умов процесу (концентрація розчину солі металу, рН, густина струму, матеріал електрода) можливо відновити тільки метал.
На аноді під час електролізу, як і в гальванічному елементі, проходить процес окиснення. Окиснюватись можуть негативно заряджені іони (аніони): кислотні залишки та атоми Оксигену води. Процес має відбуватися при мінімальному значенні потенціалу анода. Тут можна користуватись емпіричним правилом простого аніона, яке дає послідовність окиснення аніонів на аноді: чим простіший за складом аніон, тим менший потенціал він має і тим легше окиснюється:
S2-, I-, Br-, Cl-; …OH-, HO 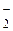 ; …SO
; …SO 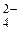 , NO
, NO 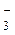 .
.
Напрямок зростання потенціалу окиснення - зліва направо. Отже, якщо у водному розчині є прості одноатомні аніони, вони окиснюються у першу чергу, наприклад:
S2- - 2 e = S,
а якщо такі аніони у розчині відсутні, то окиснюється вода і розчин стає кислим:
2Н2О - 4 е = О2 + 4Н+.
Якщо анод виготовлено з металу, який має потенціал менший, ніж необхідно для окиснювання води (< +0,82 В), то відбувається окиснення цього металу (т. з. розчинний анод):
Me0 - ze = Ме z+.
Кількісні розрахунки електролізу треба виконувати згідно з законом Фарадея:
m (Х) = 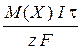 , де
, де
m (Х) – маса речовини, що окиснювалась або відновлювалась, г;
М (Х) - молярна маса цієї речовини, г /моль;
І - сила струму, А;
t - час проведення електролізу, с;
z - кількість електронів, що беруть участь у електродному процесі;
F - стала Фарадея (» 96500 Кл/моль).
Приклад. Розрахуйте масу, а для газів - об’єм (н.у.) речовин, які виділяються на електродах під час електролізу водного розчину AgNO3 з графітовими (інертними) електродами, якщо сила струму дорівнює 2А, а тривалість процесу – 1 година.
Розв’язання. Перш за все записуємо рівняння катодного й анодного процесів:
К(-): Ag+ + e = Ag (j = jmax);
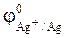 = + 0,80 B.
= + 0,80 B.
Згідно з правилом простого аніона:
A(+): Н2О - 4 е = О2 + 4Н+;
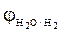 = - 0,41 B.
= - 0,41 B.
Розраховуємо масу срібла:
m (Ag) = 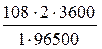 » 8,06 (г).
» 8,06 (г).
Розраховуємо об’єм кисню, використовуючи формулу закону Фарадея для газів (н. у.):
V газу = 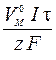 ;
;
V (O2) = 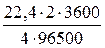 » 0,42 (л).
» 0,42 (л).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 494; Нарушение авторских прав?; Мы поможем в написании вашей работы!