
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретична частина. Еквівалентом речовини (Е) – називається така частка формульної одиниці ФО речовини, яка рівноцінна одному йону гідрогену в кислотно-основних або йонообмінних
|
|
|
|
ЛАБОРАТОРНА РОБОТА № 1
ВИЗНАЧЕННЯ МОЛЯРНОЇ МАСИ ЕКВІВАЛЕНТІВ МЕТАЛУ ОБ’ЄМНИМ МЕТОДОМ
Еквівалентом речовини (Е) – називається така частка формульної одиниці ФО речовини, яка рівноцінна одному йону гідрогену в кислотно-основних або йонообмінних реакціях або одному електрону в окисно-відновних реакціях:
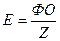 ,
,
де Z – еквівалентне число.
Під формульною одиницею розуміють або реальні структурні одиниці речовин, здатні існувати самостійно (атоми, молекули, йони), або групи атомів, що входять до складу хімічних формул атомних чи йонних кристалів. Значення Z визначається за рівнянням хімічних реакцій, в якій приймає участь дана речовина:
1. Еквівалентне число Z чисельно дорівнює валентності елементу для простих речовин.
Розрахунок еквівалентів Феруму в реакціях:
а) Fe + H2SO4 (РОЗЧ.) = FeSO4 + H2.
Fe – 2e = Fe+2, еквівалентне число становить Z =2.
б) 2Fe +6H2SO4 (КОНЦ.) = Fe2(SO4)3 +3 SO2 + 6H2O.
Fe – 3e = Fe+3, еквівалентне число становить Z =3.
2. Для кислот еквівалентне число визначається основністю кислоти (кількістю йонів гідрогену, що заміщені на йони металу):
а) H3PO4 + NaOH = NaH2PO4 + H2O, Z(H3PO4) =1
б) H3PO4 + 2 NaOH = Na2HPO4 + 2H2O, Z(H3PO4) =2
в) H3PO4 + 3 NaOH = Na3PO4 + 3H2O, Z(H3PO4) =3
3. Для основ еквівалентне число визначається кислотністю основи (кількістю гідроксогруп заміщених аніонами кислоти):
а) Al(OH)3 + HCl = Al(OH)2Cl + H2O, Z (Al(OH)3) = 1
б) Al(OH)3 + 2HCl = Al(OH)Cl2 + 2H2O, Z (Al(OH)3) = 2
в) Al(OH)3 + 3HCl = Al(OH)3 + 3H2O, Z (Al(OH)3) = 3
4. Для солей та амфотерних оксидів еквівалентне число визначається добутком заряду катіону або аніону(за модулем) n на кількість катіонів (або аніонів) m:
Z = n·m
а) NaCl, Z =1·1=1;
б) Na2SO4, Z = 1·2=2;
в) Al2(SO4)3, Z=3·2=6.
5. Визначення еквівалентного числа речовини окисника та речовини відновника у окисно-відновних реакціях.
Еквівалентне число окисника та відновника у окисно-відновних реакціях визначається кількістю прийнятих чи відданих електронів.
3 H2S + K2Cr2O7 + 4 H2SO4 = Cr2(SO4)3 + 3 S + K2SO4 + 7 H2O
відновник: H2S – 2 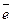 = S + 2H+, Z = 2;
= S + 2H+, Z = 2;
окисник: Cr2O72- + 14 H+ + 6e = 2 Cr3+ + 7 H2O, Z = 6.
За аналогією до молярної маси речовини вводиться поняття молярної маси еквівалентів речовини (MЕ(Х)) – маса одного моль еквівалентів речовини (г/моль-екв):
MЕ(Х) = 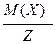 .
.
Для визначення молярних мас еквівалентів оксидів, основ, кислот і солей використовують формули:
 ;
;
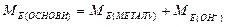 ;
;
 ;
;
 .
.
Молярний об’єм еквівалентів (VЕ(Х)) – об’єм одного моля газоподібної речовини (л/моль-екв).
Для простих двоатомних газів: 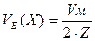 .
.
Для складних газоподібних речовин: 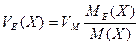 .
.
Німецькі хіміки: Венцель та Ріхтер встановили (1793 р.), що речовини реагують утворюються в еквівалентних кількостях:
nE(Х1) = nE(Х2), або  .
.
Якщо одним з учасників реакції є газоподібна речовина, закон еквівалентів можна записати у вигляді:
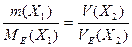 .
.
Кількість речовини еквівалента 
Експериментально еквівалент елементу можна визначити хімічним шляхом – визначенням кількості приєднаного або заміщеного елементом Гідрогену, Оксигену або іншого елементу, еквівалент якого відомий, або електрохімічним шляхом на основі закону Фарадея, згідно якого при проходженні 1Ф електроенергії через розчин електроліту на електродах утворюється один еквівалент речовини.
В даній лабораторній роботі використовується найбільш простий спосіб визначення еквівалента металу, що базується на вимірюванні об’єму водню під час реакції його витіснення з розчину сульфатної кислоти:
Me + H2SO4 = MeSO4 + H2.
Згідно закону еквівалентів, один еквівалент металу витісняє один еквівалент водню, молярна маса еквівалентів якого становить 1 г/моль-екв.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 423; Нарушение авторских прав?; Мы поможем в написании вашей работы!