
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахунки
|
|
|
|
1. Виміряний об’єм водню за атмосферних умов проведення досліду (Р, T) перераховуємо на нормальні умови за рівнянням Менделєєва-Клапейрона:
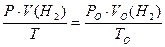 ,
,
де Р О, V О, T О тиск, об’єм та температура за нормальних умов, а Р, V, T - тиск, об’єм та температура за умов проведення досліду.
Тиск Р газів в бюретці (3) у відповідності до закону Дальтона дорівнює сумі парціальних тисків повітря РПОВ., водню Р(Н2) та насиченої водяної пари РПАРИ: Р = РПОВ + Р(Н2) + РПАРИ.
За однакових положень рівнів води в бюретках тиск РАТМ. = РПОВ. + Р(Н2) в бюретці (3) буде меншим від атмосферного на величину тиску насиченої водяної, яка залежить тільки від температури (таблиця 3):
Р = РАТМ. - РПАРИ.
Тоді, об’єм водню зведений до нормальних умов, становить:
 .
.
2. Виходячи з математичного виразу закону еквівалентів:
 ,
,
визначаємо молярну масу еквівалентівметалу МЕ:

враховуючи те, що за нормальних умов водень займає еквівалентний об’єм, рівний:
 л/моль-екв,
л/моль-екв,
а використана в досліді маса металу m(Ме) витісняє з кислоти, об’єм водню VО(Н2), зведений до нормальних умов.
Таблиця 2
Залежність тиску насиченої парціальної пари від температури
| t, 0С | Па | мм рт.ст. | t,0С | Па | мм рт.ст. |
| 2337,8 | 17,53 | ||||
| 1227,9 | 9,21 | 2486,4 | 18,65 | ||
| 1306,6 | 9,8 | 2643,7 | 19,83 | ||
| 1399,9 | 10,5 | 2809,0 | 21,07 | ||
| 1493,2 | 11,2 | 2983,7 | 22,38 | ||
| 1599,9 | 3167,2 | 23,76 | |||
| 1705,1 | 12,79 | 3361,0 | 25,21 | ||
| 1817,1 | 13,63 | 3564,9 | 26,74 | ||
| 1947,1 | 14,53 | 3779,6 | 28,35 | ||
| 2063,8 | 15,48 | 4004,9 | 30,04 | ||
| 2197,1 | 16,48 | 4242,2 | 31,82 |
3. Після визначення молярної маси еквівалентів металу розраховуємо молярну масу металу для двох значень еквівалентного числа (валентності металу) Z, рівних 2 і 3 за рівнянням:
M(Ме) =MЕ(Ме) ·Z
За таблицею Д.Менделєєва вибираємо метал з відповідною валентністю, для якого розходження розрахованого значення молярної маси не перевищує 1 –2 г/моль.
4. Розраховуємо відносну похибку досліду:
Δ пох. = 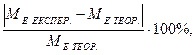
де МЕ ЕКСПЕР. – молярна маса еквівалентів металу, розрахована за отриманими під час досліду даними, МЕ ТЕОР. – теоретично розрахована молярна маса еквівалентів металу.
Контрольні завдання
1. Розрахувати молярну масу еквівалентів металу, виходячи з даних, наведених у таблиці 3.
Таблиця 3
| № | Маса металу, г | Отримана сполука, г |
| 0,347 | Сульфіт, 4,347 | |
| 1,635 | Хлорид, 3,41 | |
| 7.82 | Сульфат, 17,42 | |
| 1,73 | Нітрат, 7,93 | |
| 1,8 | Фторид, 5,6 | |
| 5,395 | Оксид, 5,795 | |
| 6,075 | Гідрогенфосфат, 30,075 | |
| 4,6 | Гідрогенсульфат, 24 | |
| 1,59 | Гідроксид, 2,44 | |
| 4,0 | Сульфід, 7,2 |
2. Розрахувати масу отриманої речовини за даними вихідних речовин (таблиця 4), використовуючи закон еквівалентів.
Таблиця 4
| № | Об'єм газу (н.у.), л | Продукти реакції |
| Cl2, 3,8 | FeCl2 | |
| SO2, 4,6 | K2SO3 | |
| O2, 7,4 | CuO | |
| F2, 6,4 | AlF3 | |
| SO3, 16,8 | Na2SO4 | |
| Cl2, 8,2 | NiCl2 | |
| SO2, 2,7 | Li2SO3 | |
| O2, 3,5 | Cr2O3 | |
| F2, 14,7 | AgF | |
| SO3, 11,4 | CaSO4 |
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 371; Нарушение авторских прав?; Мы поможем в написании вашей работы!