
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина. І. Проведення розрахунків
|
|
|
|
І. Проведення розрахунків
1. Приготувати розчин об’ємом 100 мл з молярною концентрацією еквівалентів хлоридної кислоти в розчині 0,1 моль-екв/л з заданою густиною.
2. За заданою густиною хлоридної кислоти (ρ= 1,078 г/мл) визначити масову частку кислоти в розчині за табличними даними.
3. Розрахувати масу розчиненої речовини (хлоридної кислоти), яка міститься в розчині об‘ємом 100 мл з молярною концентрацією еквівалентів розчиненої речовини 0,1 моль-екв/л за формулою:
 ,
,
звідки: m(HCl) = CЕ(НСl) . МЕ(HCl) . VРОЗЧ..
4. Розрахувати масу розчину HСl, яка містить розраховану масу розчиненої речовини - хлоридної кислоти, з формули:
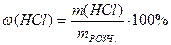 ,
,
звідки 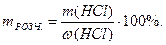
5. Розрахувати об’єм розчину хлоридної кислоти за відомою густиною:
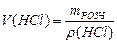 .
.
ІІ. Приготування розчину
У мірну колбу на 100 мл налити дистильованої води 1/3 від її об’єму. З бюретки прилити розрахований об'єм вихідного розчину хлоридної кислоти, перемішати вміст колби і долити дистильованою водою до мітки на шийці колби. Концентрація одержаного розчину має становити приблизно 0,1моль-екв/л. Визначити концентрацію приготовленого з високою точністю можна методом об’ємного аналізу - титруванням.
Чистою піпеткою (на 10 мл) за допомогою груші відібрати 10 мл приготовленого розчину хлоридної кислоти. Даний об’єм розчину перенести в конічну колбу та додати 2-3 краплі розчину індикатора фенолфталеїну (безбарвний в кислому середовищі і малиновий – в лужному). Закріплену в штативі бюретку заповнити титрованим розчином NaOH і встановити рівень рідини в бюретці на нульовій поділці. Конічну колбу з відібраним розчином хлоридної кислоти та індикатором поставити на аркуш білого паперу під бюретку (носик бюретки мусить на 1-2 см входити в горло колби). При постійному перемішуванні досліджуваного розчину хлоридної кислоти приливати з бюретки по краплях розчин натрій гідроксиду до моменту, коли від однієї краплі лугу розчин в колбі набуде малинового забарвлення. Це свідчитиме про те, що вся кислота в колбі нейтралізована еквівалентною кількістю лугу, а остання крапля зумовила слаболужну реакцію розчину і зміну забарвлення індикатора. Перше титрування є приблизним.
Точне титрування необхідно провести не менше трьох разів. Рівень розчину лугу в бюретці кожного разу встановлювати на нульову поділку. Луг з бюретки приливати в конічну колбу з досліджуваним розчином кислоти швидко і тільки останні 1-2 мл – повільно, щоб зафіксувати момент появи забарвлення від однієї краплі лугу.
Результати трьох титрувань не повинні відрізнятися більше, ніж на 0,1 мл. Результати записати в таблицю 10.
Таблиця 10
| № титрування | V(HCl), мл | V(NaOH), мл | CH(NaOH) | CH(HCl) |
| Середнє |
ІІІ. Обрахунки результатів дослідів
1. Розрахувати молярну концентрацію еквівалентів розчину приготовленої хлоридної кислоти, використовуючи середнє значення об’єму натрій гідроксиду та закон еквівалентів для розчинів:
V (HCl) . CН(HCl) = V(NaOH) . CН.(NaOH).
Звідси  .
.
2. Розрахувати відносну похибку досліду за формулою:
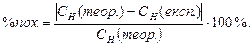
Відсоток похибки не має перевищувати 1%.
Контрольні завдання
1. Розрахувати масову частку, молярну концентрацію, молярну концентрацію еквівалентів, моляльну концентрацію розчину заданої речовини, використовуючи значення густини даного розчину та відповідні величини, наведені у таблиці 11 згідно варіанту.
Таблиця 11
| Умови | V, мл | ρ, г/мл | M(А), г | Речовина А |
| Варіант | ||||
| 1,08 | 38,8 | H2SO4 | ||
| 1,2 | 21,0 | H3PO4 | ||
| 1,1 | 41,5 | HNO3 | ||
| 1,09 | CaCl2 | |||
| 1,15 | 40,0 | NaOH | ||
| 1,18 | 60,0 | BaCl2 |
Продовження табл.11
| 1,07 | 73,0 | HCl | ||
| 1,4 | 65,0 | Na2CO3 | ||
| 1,35 | 34,2 | KOH | ||
| 1,28 | 56,2 | AlCl3 | ||
| 1,06 | 48,8 | Na2SO4 | ||
| 1,15 | 42,0 | K2CO3 | ||
| 1,17 | 55,5 | CaCl2 | ||
| 1,9 | 68,0 | Na3PO4 | ||
| 1,5 | 56,0 | KOH | ||
| 1,8 | 63,0 | HNO3 | ||
| 1,7 | 98,0 | H2SO4 | ||
| 1,25 | 24,0 | NH4OH | ||
| 1,5 | 78,0 | MgCl2 | ||
| 1,05 | 55,0 | H3PO4 |
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 375; Нарушение авторских прав?; Мы поможем в написании вашей работы!