
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретична частина. Експериментальна частина
|
|
|
|
ЛАБОРАТОРНА РОБОТА № 7
Експериментальна частина
Визначення величини рН розчинів електролітів
За величиною рН можна не тільки визначити реакцію середовища розчину електроліту, а й порівняти силу відповідних кислот і основ.
а) В одну пробірку налийте 5-6 крапель 0,1 н. розчину СН3СООН, а в другу 5-6 крапель 0,1 н. НС1 і додайте до них 1-2 краплі універсального індикатора або на полоску універсального індикаторного паперу нанесіть скляною паличкою декілька крапель розчину СН3СООН і НС1. Визначте рН досліджуваних розчинів. Зробіть висновок відносно сили ацетатної кислоти. Порівняйте значення рН за універсальним індикаторним папером з розрахунковими значеннями рН 0,1 н. СН3СООН і 0,1 н. HCl. За відомим значенням рН і концентрацією розчину СН3СООН визначте ступінь дисоціації цієї кислоти.
б) Способом, аналогічним п.а визначте рН 0,1 н розчину NH4OH та 0,1 н. NaOH.
Порівняйте ці значення з розрахунковими. Зробіть висновок про силу амоній гідроксиду. Знаючи рН розчину NH4ОН і вихідну концентрацію, розрахуйте ступінь дисоціації цього розчину.
Таблиця 14
Колір універсального індикатора в залежності від рН
| рН | Колір | рН | Колір |
| 1-3 | червоний | зелено-блакитний | |
| 4-5 | оранжевий | 9-10 | блакитний |
| жовтий | 11-13 | фіолетовий | |
| зелений |
Контрольні завдання
Для наведених нижче речовин (таблиця 15):
1) скласти рівняння дисоціації;
2) розрахувати ступінь дисоціації, рH розчину
3) для кислот розрахувати концентрацію іонів Н+, для основ – йонів ОН -.
Таблиця 15
| № | Речовина | КД | CM, моль/л |
| HF | 7,2.10–4 | 0,1 | |
| HF | 7,2.10–4 | 0,001 | |
| HNO2 | 4.10–4 | 0,001 | |
| HNO2 | 4.10–4 | 0,01 | |
| HCN | 7,2.10–10 | 0,01 | |
| HCN | 7,2.10–10 | 0,001 | |
| H3BO3 | 5,8.10–10 | 0,01 | |
| H3BO3 | 5,8.10–10 | 0,1 | |
| H2S | 1,1.10–7 | 0,001 | |
| H2CO3 | 4,4.10–7 | 0,001 | |
| H2CO3 | 4,4.10–7 | 0,01 | |
| H3PO4 | 7,1.10–3 | 0,01 | |
| H3PO4 | 7,1.10–3 | 0,1 | |
| CH3COOH | 1,8.10–5 | 0,1 | |
| CH3COOH | 1,8.10–5 | 0,001 | |
| NH4OH | 1,7.10–5 | 0,01 | |
| NH4OH | 1,7.10–5 | 0,1 | |
| H2Se | 6.10–8 | 0,1 | |
| H2SO3 | 1,6.10–2 | 0,01 | |
| H2S | 1,1.10–7 | 0,01 |
ГІДРОЛІЗ СОЛЕЙ
Гідроліз солі – це обмінна реакція йонів солі з молекулами води, в результаті чого утворюється слабкий електроліт і змінюється рН середовища.
Гідролізуються лише ті солі, до складу яких входить залишок слабкого електроліту, наприклад NH4Cl:
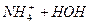 L
L  ,
,
 L
L 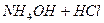 .
.
В результаті гідролізу цієї солі утворюється слабка основа NH4ОН і сильна кислота НС1, рН цього розчину буде кислим (рН < 7).
Солі, до складу яких входять багатозарядні залишки слабких електролітів, гідролізуються ступінчасто, наприклад К2СО3:
І ступінь: 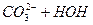 L
L 
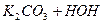 L
L  ; рН > 7.
; рН > 7.
Як правило, самовільно гідроліз відбувається тільки за І ступенем. Щоб змістити йонну рівновагу і підсилити гідроліз цієї солі, необхідно додати сильну кислоту, щоб нейтралізувати лужну реакцію розчину.
ІІ ступінь: 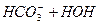



Продуктами повного гідролізу цієї солі буде слабка карбонатна кислота (СО2 + Н2О) і сильна основа КОН.
Якщо сіль утворена слабкою кислотою і слабкою основою, то гідроліз такої солі одночасно відбувається за катіоном і за аніоном, наприклад СН3COONH4:
 L
L 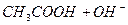 ,
,
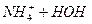 L
L  ,
,
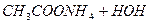 L
L 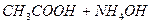 .
.
Реакція такої солі майже нейтральна.
Кількісно гідроліз солей характеризується величиною ступеня та константи гідролізу. Ступенем гідролізу (h) солі називається відношення молярної концентрації гідролізованої солі до загальної молярної концентрації солі в розчині:

Константа гідролізу солі тісно зв’язана з константою дисоціації слабкого електроліту, що утворюється в результаті гідролізу:
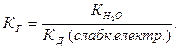
Ступінь та константа гідролізу солі зв’язані залежністю відповідно закону Оствальда:
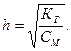
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 388; Нарушение авторских прав?; Мы поможем в написании вашей работы!