
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗАНЯТТЯ № 8
|
|
|
|
1. ТЕМА. Основи титриметричного аналізу.
2. ОБҐРУНТУВАННЯ TЕМИ. У практиці клінічних і науково-дослідних лабораторій широко застосовуються титриметричні методи аналізу, які грунтуються на реакції комплексоутворення катіонів металів з комплексонами.
Комплексони застосовують у лабораторіях для визначення мікроелементів в біологічних рідинах, при аналізі лікарської сировини, у санітарно-гігієнічному аналізі, наприклад, для визначення твердості питної води та промислових вод. Знання особливостей будови комплексних сполук та можливостей комплексонометричного методу необхідні для вивчення біохімії, фармакології, гігієни, дисциплін медичного профілю.
3. МЕТА. Сформувати уявлення про комплексонометричний метод титриметричного аналізу та особливості його застосування, навчитися проводити комплексонометричне визначення загальної твердості води,
Студент повинен знати:
- суть методу комплексонометрії, особливості застосування трилону Б та індикаторів;
- види твердості води та методи її усунення;
вміти:
- проводити титрування досліджуваної рідини розчином трилону Б;
- виконувати розрахунки в комлексонометричному аналізі;
оволодіти навичками:
- визначення загальної твердості води методом комплексонометрії.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про комплексні сполуки.
2) Загальні уявлення про твердість води.
3) Теорія розчинів, види концентрації розчинів.
4) Суть та техніка виконання титриметричного аналізу.
5) Проведення розрахунків у титриметричному аналізі.
(Матеріал шкільної програми та попередніх занять з хімії)
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ
Комплексні сполуки

Комплексони


 Індикатори методу Комплексонометрія
Індикатори методу Комплексонометрія
комплексонометрії
Визначення загальної Твердість води та
 твердості води методи її усунення
твердості води методи її усунення
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів)
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Суть методу комплексонометрії. | 1.1. Реакції, що лежать в основі методу. 1.2. Поняття про комплексони. 1.3. Індикатори методу комплексонометрії. 1.4. Застосування комплексонометричного аналізу. |
| 2. Визначення загальної твердості води. | 2.1. Загальна, тимчасова, постійна твердість води. 2.2. Методи усунення твердості води. 2.3. Визначення загальної твердості води методом комплексонометрії. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів)
1) При комплексонометричному визначенні загальної твердості води відбувається утворення двох комплексних сполук. Пояснити, яка сполука буде більш стійкою.
а) сполука іонів кальцію з трилоном Б;
б) сполука іонів кальцію з індикатором;
в) сполука іонів кальцію з буфером;
г) сполука індикатора з трилоном Б.
2) Пояснити, які речовини застосовуються для пом’якшення води.
а) сода, гідроксид натрію, ортофосфат натрію;
б) сода, гашене вапно, ортофосфат натрію;
в) гідроксид натрію, гашене вапно, розчин аміаку;
г) хлороводнева кислота, ортофосфорна кислота, сірчана кислота.
3) Вказати, у якому середовищі проводять комплексонометричне визначення твердості води
а) у нейтральному; б) у кислому; в) у лужному.
4) Визначити загальну твердість води (ммоль-екв./дм3), якщо на титрування 50 см3 водопровідної води витрачено 5,6 см3 розчину трилону Б з молярною концентрацією еквівалента 0,05 моль/дм3.
а) 5; б) 50; в) 0,5; г) 5,5.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь а).
При комплексонометричному визначенні загальної твердості води послідовно утворюються дві комплексні сполуки. Спочатку катіони кальцію (магнію) утворюють комплекс з індикатором винно-червоного кольору. При титруванні трилоном Б катіони кальцію (магнію) переходять у більш стійкий комплекс з трилоном, який забарвлення не має. Індикатор, що вивільняється при цьому, завдяки лужному середовищу, яке створюється буферним розчином, забарвлює розчин у синій колір.
2) Правильна відповідь б).
Сода, гашене вапно, ортофосфат натрію з катіонами кальцію та магнію твердої води утворюють нерозчинні сполуки і тим самим зменшують твердість води:
Ca2+ + CO32- = CaCO3 ↓; 3Ca2+ + 2PO43- = Ca3(PO4)2↓
(сода) (ортофосфат)
усунення постійної твердості;
Са2+ + 2 НСО3- + Са2+ + 2 ОН- = 2СаСО3↓ + 2Н2О
(вапно)
Mg2+ + 2 HCO3- + 2 Ca2+ + 4OH- = Mg(OH)2↓ + 2 CaCO3↓ + 2H2O
(в а п н о)
усунення тимчасової твердості;
Всі інші відповіді містять частково або повністю речовини, не здатні усунути твердість води.
3) Правильна відповідь в).
Правильна відповідь б).
Загальну твердість води (Тводи, ммоль-екв./дм3) обчислюють за формулою:
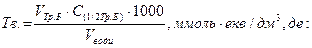
V Тр.Б – середнє арифметичне значення об’єму трилону Б, мл;
Vводи – об’єм води, що титрувався, мл;
С(1/2 Тр. Б) – молярна концентрація еквівалента трилону Б, моль/дм3.

8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Визначення загальної твердості води методом комплексонометрії.
Кожний студент одержує у викладача пробу води та визначає її твердість (індивідуальна робота).
Для цього відібрати піпеткою 25,0 (або 20,0) мл води, твердість якої визначається, перенести у колбу для титрування. Додати 10 мл аміачного буферного розчину з рН 10 та 20-30 мг (на кінці шпателя) сухої суміші індикатора хромогену чорного (еріохром чорний Т) з хлоридом натрію. Розчин у колбі набуває винно-червоного кольору. Бюретку заповнити робочим розчином грилону Б і титрувати до переходу забарвлення розчину в колбі у синє. Титрування повторити ще мінімум двічі. Для розрахунків взяти середнє арифметичне значення об’єму трилону Б.
Загальну твердість води розрахувати за формулою:
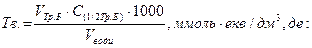
V Тр.Б – середнє арифметичне значення об’єму трилону Б, мл;
Vводи – об’єм води, що титрувався, мл;
С(1/2 Тр. Б) – молярна концентрація еквівалента трилону Б, моль/дм3.
8.2. Оформлення протоколу лабораторної роботи.
Записуючи у зошит результати експериментального визначення твердості води, обов'язково вказати номер проби води, виданої викладачем.
9. ЛІТЕРАТУРА
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 20-с. 359-363.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Селезнев К.А. Аналитическая химия. М., Химия, 1973. с. 222-228.
4. Бабков А.В. и др. Практикум по общей химии с элементами количественного анализа. М., Высшая школа, 1978, с. 151-157.
ЗАНЯТТЯ № 9.
1. ТЕМА. Кислотно-основна рівновага в організмі.
Водневий показник біологічних рідин.
2. ОБҐРУНТУВАННЯ ТЕМИ. Внутрішні середовища організму - кров, лімфа, шлунковий сік, сеча, слина та ін. - є водними розчинами. рН цих розчинів впливає на життєдіяльність клітин, тканин, органів та організму в цілому, тому що, по-перше, іони водню здійснюють каталітичний вплив на біохімічні перетворення, по-друге, ферменти і гормони мають біологічну активність тільки в певному інтервалі значень рН, по-третє, величина концентрації іонів водню впливає на величину осмотичного тиску біологічних рідин. Стабільність величини рН забезпечується дією фізіологічних механізмів і буферними системами. Гідролізні реакції в організмі мають велике значення в обміні речовин, підтримуванні постійної реакції середовища біологічних рідин організму.
Постійність рН систем організму - необхідна умова його нормальної життєдіяльності, контроль цієї величини дає можливість виявити різні види патології і правильно поставити діагноз. Тому визначення рН біологічних рідин широко застосовується в клінічних і біохімічних дослідженнях, а також у фармацевтичній практиці. Адже фармакологічна дія лікарських препаратів залежить від рН вихідних розчинів і від рН біологічних рідин.
Потенціометричний метод визначення рН має ряд переваг порівняно з індикаторним: він точніший (дає змогу вимірювати рН з точністю 0,02-0,05), а також дає можливість вимірювати рН багатокомпонентних систем та забарвлених розчинів. З розвитком електродної техніки цей метод все ширше застосовується у біології, медицині та фармації.
Дуже важливими для організму є процеси гідролізу. Наприклад, при гідролізі АТФ виділяється енергія, а гідроліз солей впливає на величину рН середовища крові та тканинних рідин, перетравлювання їжі також пов’язане з гідролізом. На гідролітичних процесах ґрунтується дія деяких хіміотерапевтичних засобів. Завжди треба враховувати процеси гідролізу при визначенні терміну зберігання багатьох лікарських препаратів. Знання теорії гідролітичних процесів необхідне для подальшого вивчення біохімії, фізіології, фармакології.
3. МЕTA. Сформувати уявлення про роль водневого показника, гідролітичних процесів в організмі людини. Опанувати методику потенціометричного визначення рН.
Вивчити основні теоретичні положення гідролізу солей. Сформувати уявлення про значення гідролітичних процесів в обміні речовин в організмі та у дії лікарських засобів.
Студент повинен знати:
- суть поняття "водневий показник" та його значення для функціонування живого організму;
- величини рН основних біологічних рідин організму;
- причину порушення кислотно-основного балансу в організмі;
- основи теорії гідролізу солей;
- визначення понять "ступінь гідролізу", "константа гідролізу";
- як впливає гідроліз солей на величину рН;
- значення гідролізу для процесів метаболізму;
- основні принципи іонометрії, види електродів визначення та порівняння;
вміти:
- проводити розрахунки значень рН та концентрацій іонів Гідрогену (гідроксонію).
- писати рівняння гідролізу солей у молекулярній та іонній формах;
- оцінювати вид середовища у розчинах солей, що піддаються гідролізу.
овлодіти навичками:
- визначення рН розчинів і біологічних рідин потенціометричним методом за допомогою скляного електрода.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про кисле, нейтральне і лужне середовище. Шкала рН.
2) Поняття про гідроліз солей.
(матеріал шкільної програми з хімії).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
Дисоціація води, Гідроліз солей

 іонний добуток води
іонний добуток води
 Ступінь і константа гідролізу Роль гідролітичних процесів
Ступінь і константа гідролізу Роль гідролітичних процесів
 Водневий показник. в обміні речовин
Водневий показник. в обміні речовин
Зміна рН середовища
 Шкала рН. при гідролізі
Шкала рН. при гідролізі
Реакція середовища

Значення рН рідин. Визначення рН за допомогою скляного електрода.
організму людини Електроди визначення та електроди порівняння
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів)
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Дисоціація води. | 1.1. Константа дисоціації води. 1.2. Іонний добуток води. |
| 2. Водневий показник. | 2.1. Шкала рН. 2.2. Значення рН рідин організму людини. 2.3. Зниження рН. |
| 3. Гідроліз солей. | 3.1 Поняття про гідролітичні процеси. Види солей, що гідролізуються. 3.2. Ступінь гідролізу, його залежність від концентрації і температури. 3.3. Константа гідролізу. 3.4. Вплив гідролізу на реакцію середовища. 3.5. Роль гідролітичних процесів у обміні речовин. |
| 4. Потенціометричне визначення рН. | 4.1. Електроди визначення. 4.2. Електроди порівняння. 4.3. Принцип дії скляного електрода. 4.4. Гальванічне коло для визначення рН зі скляним електродом. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів)
1) Вказати, як пов’язані між собою значення рН і рОН в розчині.
а) рН = рОН в) рН ∙ рОН = 7
б) рН + рОН =14г) рН/рОН = 1
2) Пояснити, як може впливати зміна рН біологічної рідини на фізіологічні процеси.
а) залежить від виду біологічної рідини;
б) при збільшенні рН швидкість процесів зростає;
в) при збільшенні рН швидкість процесів зменшується, а при зниженні рН швидкість зростає;
г) зміна рН може змінити швидкість процесу, або зовсім його припинити.
3) Пояснити, чому знижується рН в зоні запалення.
а) в зоні запалення утворюються продукти неповного окиснення - органічні кислоти;
б) в зоні запалення різко сповільнюється відток продуктів метаболізму;
в) в зоні запалення пригнічується окиснення і зростає
відновлення;
г) в зоні запалення рН не змінюється, бо його значення не залежить від напряму процесів метаболізму.
4) Вибрати групу солей, що піддаються гідролізу при розчиненні у воді.
а) хлорид натрію, сульфат амонію;
б) ціанід калію, карбонат натрію;
в) нітрат калію, ацетат кальцію;
г) ацетат амонію, сульфат натрію.
5) Вибрати правильне іонне рівняння (коротка іонна форма) реакції гідролізу карбонату натрію.
а) Na+ + Н2О == NаОН + Н+ в) Nа+ + ОН- == NаОН
б) СОз2- + 2H+ == Н2COзг) СО32- + H2O == HCO3- + OH-
6) Вказати вид середовища, що створюється при розчиненні сульфату цинку у воді.
а) кисле; б) лужне; в) нейтральне; г) в залежності від концентрації солі.
7) Пояснити залежність ступеня гідролізу від температури і концентрації солі.
а) ступінь гідролізу не залежить від температури і концентрації;
б) ступінь гідролізу збільшується при збільшенні концентрації і температури;
в) ступінь гідролізу зменшується при збільшенні концентрації і температури;
г) ступінь гідролізу зменшується при збільшенні концентрації і збільшується зі зростанням температури.
8) Пояснити, як буде змінюватися константа гідролізу трьох солей, що утворені однією сильною основою і різними по силі кислотами.
а) константа гідролізу буде збільшуватися із збільшенням сили кислоти;
б) константа гідролізу буде зменшуватисяіз збільшенням сили кислоти;
в) константа гідролізу не буде залежати від сили кислот;
г) константа гідролізу буде обумовлена величиною константи дисоціації основи.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь б).
Оскільки рН = -lg[H+], а рОН = - lg[OH-], при логарифмуванні рівняння іонного добутку води маємо:
[Н+] ∙ [ОН-] = 10-14, або: -lg[Н+] + (-lg[OН-]) = 14
рН + рОН = 14
lg[H+] + lg[OH-] = lg10-14,
lg[H+] + lg[OH-] = -14,
2) Правильна відповідь г).
Вплив рН середовища на фізіологічні процеси настільки великий, що вже незначна зміна рН може помітно змінити швидкість процесу, навіть зовсім його припинити. Це пов’язано з тим, що ферменти єречовинами білкової природи, структура і активність яких у значній мірі залежить від рН. Зміна структури фермента пригнічує його каталітичну активність або призводить до її зникнення. Наприклад, фермент амілаза, що міститься в слині і прискорює розщеплення крохмалю, найбільш активний при рН 6,7. Активність ферменту шлункового соку - пепсину, проявляється при рН 1,5-2,5. Зміна рН викликає інактивацію пепсину і амілази.
3) Правильна відповідь а).
Процес повного окиснення у звичайних умовах йде з утворенням вуглекислого газу і води. У зоні запалення при ураженні тканин спостерігається посилення анаеробного (безкисневого) окиснення з утворенням органічних кислот (молочна кислота та ін.), які знижують рН середовища у зоні запалення.
4) Правильна відповідь б).
Тільки солі, що утворені сильною кислотою і сильною основою, не піддаються гідролізу. Таких солей немає тільки у відповіді б). У всіх інших вони є (хлорид натрію (а), нітрат калію (в), сульфат натрію (г)).
5) Правильна відповідь г).
Карбонат натрію - сіль, що утворена сильною основою і слабкою кислотою. Гідроліз іде по аніону:
Na2CO3 + Н2О == NaHCO3 + NаОН
СОз2- + Н2О == НСОз- + ОН-
6) Правильна відповідь а).
Сульфат цинку – сіль, що утворена сильною кислотою і слабкою основою.
Гідроліз іде по катіону: Zn2+ + H2O == (ZnОН)+ + Н+.
Утворення при гідролізі катіонів Гідрогену (Н+) зменшує рН розчину
сульфату цинку, середовище стає кислим.
7) Правильна відповідь г).
8) Правильна відповідь б).
Чим менша константа дисоціації кислоти (чим менша сила кислоти), тим в більшій мірі відбувається гідроліз солі, утвореної такою кислотою. Отже, константа гідролізу солі зменшується із збільшенням сили кислоти або із збільшенням константи її дисоціації, тому що гідроліз цих солей іде по аніону:
Аn- + Н2О == НАn + ОH-, а константа гідролізу може бути обчислена за формулою:
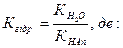
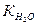 – іонний добуток води;
– іонний добуток води;
К НАn – константа дисоціації кислоти;
К гідр. – костанта гідролізу.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ
8.1. Підготовка приладу до роботи.
Визначення рН потенціометричним методом проводиться на іономірі ЭВ-74. На початку роботи необхідно ознайомитися з паспортом та інструкцією до приладу. Порядок підготовки іономіра до роботи:
- натиснути кнопки “t” і “-1-І9" та ввімкнути прилад (попередньо підключивши його до мережі); прогріти протягом 30хв .;
- зібрати гальванічне коло з робочого (вимірювального) і допоміжного (порівняльного) електродів.
Вимірювальним є скляний електрод ЭСЛ - 43 - 07 з водневою функцією. Допоміжним є хлорсрібний електрод із сталим значенням потенціалу (0,201 ±: 0,003 В). Електроди закріпити в утримувачі над спеціальним столиком для розчину і підключити у відповідні гнізда на задній панелі приладу.
Іономір настроєний по контрольних буфернихрозчинах за методикою, що дається в інструкції до приладу.
8.2. Визначення рН біологічних рідин.
Визначення рН біологічної рідини проводиться у такій послідовності:
- у хімічний стаканчик з біологічною рідиною занурити електроди - утворити гальванічне коло;
- натиснути кнопки "аніони/катіони", "рХ" і загального діапазону
"-І-І9 ". Кнопку "Х/Х" залишити не натиснутою, що відповідає вимірюванню концентрації одновалентних іонів;
- визначити приблизне значення рН за шкалою загального діапазону;
- натиснути кнопку одного з піддіапазонів, що містить приблизне значення рН, і визначити точне значення рН за шкалою, що відповідає цьому діапазону.
8.3. Обробка результатів та оформлення протоколу лабораторної роботи.
1) Точне значення рН біологічної рідини занести у таблицю:
| № вимі-рюван-ня | Вид біологіч-ної рідини | рН | аН+, моль/л | Кв | аОН-, моль/л | рОН | вид середовища |
2) За точними значеннями рН для кожної біологічної рідини обчислити активність катіонів Гідрогену aН+:
рН = - lg aH+, або lg aH+ = -рН
3) Оскільки для кожного розчину на водній основі (відповідно і для біологічної рідини) значення іонного добутку води Кв є сталим, знаходимо активність гідроксид-іонів за формулою (за стандартної температури):
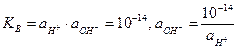
4) Розрахувати значення рОН за формулою:
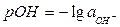
5) Результати всіх розрахунків занести у таблицю.
6) За величиною рН зробити висновок про вид середовища у відповідній біологічній рідині.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с.138-143, 151-161.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. Киев, Вища школа. 1986, с. 105-126.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высшая школа, 1975, с. 66-69.
ЗАНЯТТЯ № 10.
1. ТЕМА. Буферні системи, класифікація та механізм дії.
2. ОБҐРУНТУВАННЯ ТЕМИ. Одним з найважливіших аспектів гомеостазу організму людини є підтримування постійного значення рН, що здійснюється буферними системами та фізіологічними механізмами. Буферні системи регулюють концентрацію іонів водню та гідроксид-іонів, а також перебіг реакцій, що залежать від величини рН. Знання про буферні системи необхідні при вивченні біохімії, фізіології, фармакології та клінічних дисциплін.
3. МЕТА. Сформувати уявлення про буферні системи та механізм їх дії. Визначити вплив кислот, основ та розведення на рН буферних розчинів.
Студент повинен знати:
- визначення поняття "буферна система";
- класифікацію буферних систем за складом;
- механізм буферної дії;
- склад типових буферних систем;
- фактори, що впливають на величину рН буферної системи;
вміти:
- складати рівняння реакцій, що характеризують буферну дію;
- проводити розрахунки за рівнянням Гендерсона-Гассельбаха;
оволодіти навичками:
- визначення впливу кислот, основ та розведення на рН буферних розчинів.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДН ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про сильні і слабкі електроліти.
2) Поняття про водневий показник і шкалу рН.
3) Методи визначення рН розчинів.
(Матеріал шкільної програми та попередніх занять з хімії).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
 Буферні розчини
Буферні розчини
 |  |
Класифікація Механізм дії рН буферних
 буферних систем буферних систем систем
буферних систем буферних систем систем

Склад типових Визначення впливу кислот,
буферних систем основ, розведення на рН
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ (самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Поняття про буферні розчини. | 1.1. Класифікація буферних розчинів за складом. 1.2. Механізм дії буферних систем. |
| 2. рН буферних розчинів. | 2.1. Рівняння Гендерсона-Гассельбаха. 2.2. Вплив різних факторів на значення рН буферного розчину. |
7. ЗАВДАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів)
1) Назвати кількість основних типів буферних систем (за складом);
а) один; б) два; в) три; г) чотири
2) Вибрати правильну формулу для розрахунку рН буферної системи HCN - NaCN
а) 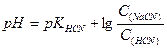 б)
б) 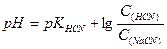
в) 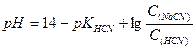 г)
г) 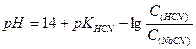
3) Розрахувати рН буферного розчину, що був приготований з 0,040 л розчину аміаку з концентрацією 0,15 моль/л та 0,020 л розчину хлориду амонію з концентрацією 0,25 моль/л. 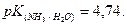
а) 4,67; б) 6,42; в) 9,33; г) 10,12.
4) Пояснити, чому при додаванні невеликої кількості сильної кислоти до гідрогенкарбонатної буферної системи її рН практично не змінюється.
а) підвищується ступінь дисоціації гідрогенкарбонату натрію;
б) рівновага зміщується в бік утворення катіонів водню:
CO2 + H2O == H+ + НСОз-
в) під впливом сильних кислот розкладається вугільна кислота;
г) сильна кислота замінюється еквівалентною кількістю слабкої вугільної кислоти.
5) Вказати, від яких факторів залежить рН буферної системи.
а) від природи слабкого електроліту (кислоти чи основи);
б) від співвідношення концентрацій компонентів буферної системи;
в) від концентрації слабкого електроліту (кислоти чи основи);
г) від концентрації солі.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь б).
Буферні системи за складом бувають двох основних типів:
- слабка кислота - сіль слабкої кислоти та лугу;
- слабка основа - сіль слабкої основи та сильної кислоти.
2) Правильна відповідь а).
Рівняння Гендерсона-Гассельбаха для цієї системи буде мати такий вигляд:
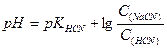
3) Правильна відповідь в).
Приготований розчин належить до буферних розчинів основного типу. Для розрахунку значення його рН використовуємо рівняння;
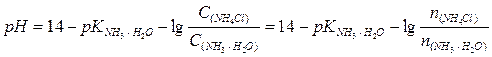
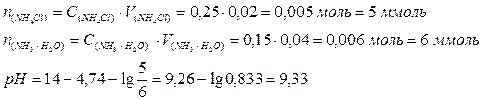
рН буферного розчину дорівнює 9,33.
4) Правильна відповідьг).
При додаванні сильної кислоти до гідрогенкарбонатного буферного розчину має місце її взаємодія з гідрокарбонатом натрію:
Н+ + НСО3- = H2O + CO2
При цьому сильна кислота заміщується еквівалентною кількістю слабкої вугільної кислоти, іїї вплив на значення рН буде майже непомітним.
5) Правильні відповіді а) і б).
рН буферної системи залежить від природи слабкого електроліту (рК) і співвідношення компонентів (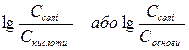 ).
).
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Визначення впливу розведення на рН буферних розчинів.
У першу пробірку налити 6 мл буферного розчину, в другу - 2 мл цього ж розчину та 4 мл дистильованої води. У кожну пробірку додати по 2 краплі індикатора метилового червоного. Зміст пробірок перемішати і порівняти забарвлення.
8.2. Визначення впливу кислоти та лугу на рН буферного розчину.
У три пробірки налити по 4 мл буферного розчину з відомим значенням рН. Потім додати в одну пробірку 2 краплі розчину НСІ
(С = 0,1 моль/л), у другу - 2 краплі розчину NaOH (С = 0,1 моль/л), у третю - 2 краплі дистильованої води і в кожну - по 2 краплі індикатора метилового червоного. Розчини перемішати і порівняти забарвлення.
8.3. Оформлення протоколу лабораторної роботи.
За результатами спостережень зробити висновок про вплив кислот, лугів та розведення на рН буферних розчинів.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 161-169.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г, Цыганенко А.Я. Биофизическая химия. Киев, Вища школа, 1986,с, 77-82.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. Высшая школа. с. 90-96.
ЗАНЯТТЯ № 11
1. ТЕМА. Визначення буферної ємності. Роль буферів у біосистемах.
2.ОБҐРУНТУВАННЯ ТЕМИ. Рідини живого організму – кров, сеча, внутрішньо-клітинна рідина, лімфа та інші, містять буферні системи для підтримування постійного значення рН. При багатьох захворюваннях спостерігається зміщення рН або у кислу область (ацидоз), або в лужну (алкалоз). Відомо, що тривале зміщення рН крові на 0,3-0,4 одиниці рН може призвести до смерті хворого. Тому буферна ємність є дуже важливою характеристикою буферної системи або сукупності систем, бо характеризує здатність до нейтралізації речовин, що можуть змінити величину рН. Для точного визначення буферної ємності застосовується потенціометричний метод, який дає змогу чітко зафіксувати зміну рН.
3. МЕТА. Сформувати уявлення про основні буферні системи організму людини, кислотно-лужну рівновагу в організмі та її порушення, буферну ємність буферних систем. Оволодіти методикою потенціометричного визначення буферної ємності.
Студент повинен знати:
- основні буферні системи організму людини,їх склад, особливості
та значення;
- що таке буферна ємність буферних систем, її залежність від різних факторів;
- значення кислотно-лужної рівноваги в організмі людини та
наслідки її зміщення, ацидоз і алкалоз;
- основні закономірності потенціометричного титруваннятапотенціометричного визначення буферної ємності;
вміти:
- підбирати електроди та складати гальванічне коло для визначення буферної ємності;
- проводити розрахунки за формулами буферної ємності по кислоті та по лугу;
оволодіти навичками:
- потенціометричного визначення буферної ємності сироватки крові за допомогою скляного та хлорсрібного електродів.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ,
НЕОБХІДНІ ДЛЯ ЗАСВОЕННЯ ТЕМИ.
1) Поняття про електроди, гальванічні кола, механізм виникнення потенціалів.
2) Поняття про буферні розчини, механізм буферної дії. Рівняння для визначення рН буферної системи.
3) Навички потенціометричного визначення рН
(матеріал попередніх занять).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
 Буферні розчини в організмі людини
Буферні розчини в організмі людини
 |  |
Буферна ємність Основні види буферних Порушення кислотно-
буферних систем систем крові лужної рівноваги
 |  |
Потенціометричне визначення Алкалоз. Ацидоз
буферної ємності.
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ (самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Буферні системи в організмі людини. | 1.1. Гідрогенкарбонатна буферна система. 1.2. Фосфатна буферна система. 1.3. Гемоглобін-оксигемоглобінова буферна система. 1.4. Білкова (амінокислотна) буферна система. |
| 2. Поняття про буферну ємність буферних систем. | 2.1. Залежність буферної ємності від концентрації і співвідношення компонентів 2.2. Формула для розрахунку буферної ємності. 2.3. Потенціометричне визначення буферної ємності сироватки крові. |
| 3. Поняття про кислотно-лужну рівновагу в організмі. | 3.1. Основні фактори кислотно-лужної рівноваги крові (величина рН, концентрація СО2 і гідрогенкарбонат-іонів) 3.2. Поняття про лужний резерв крові. 3.3. Зміщення кислотно-лужної рівноваги: ацидоз і алкалоз (метаболічний і респіраторний). |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вибрати групу буферних систем, до якої входять тільки буферні системи організму людини.
а) ацетатна, гідрогенкарбонатна, фосфатна;
б) білкова, фосфатна, амінокислотна;
в) аміачна, ацетатна, фосфатна;
г) гідрогенкарбонатна, фосфатна, аміачна.
2) Пояснити, на чому ґрунтується механізм буферної дії фосфатної буферної системи.
а) на тому, що фосфорна кислота є електролітом середньої сили;
б) на тому, що солі, які утворюють фосфатну буферну систему, повністю дисоціюють на іони;
в) на тому, що дигідрогенфосфат-іон дисоціює, як слабка кислота;
г) на тому, що солі, які утворюють фосфатну буферну систему, гідролізуються, регулюючи тим самим величину pH.
3) Вказати, від яких факторів залежить величина буферної ємності.
а) концентрація, pH, природа буферної системи;
б) концентрація, співвідношення компонентів;
в) pH, температура;
г) температура, співвідношення компонентів, природа буферної системи.
4) Пояснити, при якому співвідношенні солі і кислоти величина буферної ємності буде максимальною і по кислоті і по лугу.
а) 50:50; б) 30:70; в) 80:20; г) 20:80.
5) Пояснити, як називаеться порушення кислотно-лужної рівноваги,що виникає при тривалому уповільненому видиханні вуглекислого газу.
а) респіраторний ацидоз; в) метаболічний ацидоз;
б) респіраторний алкалоз; г) метаболічний алкалоз.
6) Вибрати пару електродів, з яких можна скласти гальванічне коло для потенціометричного визначення буферної ємності.
а) хлорсрібний і платиновий; в) скляний і платиновий;
б) водневий і хінгідронний; г) скляний і хлорсрібний.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь б).
Серед наведенних буферних систем лише ацетатна та аміачна не є буферними системами організму людини. Вони не входять тільки у відповідь б).
2) Правильна відповідь в).
Фосфатна буферна система складається з двох кислих солей дигідрогенфосфату і гідрогенфосфату, що зв язані між собою рівновагою:
H2PO4- D H++ HPO42-
Отже, дигідрогенфосфат-іон H2PO4- є слабкою кислотою,а гідрогенфосфат-іон HPO42- є аніоном цієї кислоти. Таким чином,система з цих двох солей за механізмом дії відповідає системі: слабка кислота, сіль слабкої кислоти і сильної основи.
3) Правильна відповідь б).
Буферна ємність, як характеристика здатності системи зберігати сталу величину pH при додаванні кислот і лугів, залежить від
концентрації компонентів у буферній системі і від їх співвідношення. Чим більша концентрація компонентів, тим більше кислот і лугів може нейтралізувати буферна система без відчутної змінирН.
4) Правильна відповідь а).
При співвідношенні компонентів буферної системи 1: 1 буферна ємність по кислоті і по лугу буде максимальною порівняно з іншими варіантами. Саме при такому співвідношенні вплив кислоти й лугу на зміну величини рН буферної системи буде мінімальним, Наприклад, при порівнянні трьох можливих типів співвідношень сіль:кислота (у ммоль):
а) 50: 50 б) 30: 70 в) 80: 20
будемо мати такі результати:
- додавання 10 ммоль НСІ змінить співвідношення так:
а) 40: 60 6) 20: 80 в) 70: 30
і відносна зміна співвідношення буде такою:
а) 0,67 б) 0,58 в) 0,58
- додавання 10 ммоль NаОН змінить співвідношення так:
а) 60: 40 б) 40: 60 в) 90: 10
і відносна зміна співвідношення буде такою:
а) 1,50 б) 1,56 в) 2,25
Таким чином, можна зробити висновок, що відхилення співвідношення від 1: 1 (50: 50) призводить до більш значної зміни співвідношення компонентів, що більшою мірою впливатиме на зміну рН буферної системи.
5) Правильна відповідь а).
При тривалому уповільненому видиханні СО2 кров буде поступово збагачуватися на вуглекислоту, що призведе до часткового збільшення кислотності і зменшення рН. Це явище зветься ацидоз. А оскільки це порушення пов’язане з диханням, такий ацидоз називається респіраторним.
6) Правильна відповідь г).
Гальванічне коло повинно складатися з електрода визначення, потенціал якого буде залежати від рН, і електрода порівняння, потенціал якого постійний. Цьому правилу відповідає пара електродів: скляний і хлорсрібний. Скляний електрод - це електрод визначення, а хлорсрібний електрод - це електрод порівняння.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
Потенціометричне визначення буферної ємності сироватки крові проводиться на приладі "Іономір ЭВ-74", що заздалегідь настроєний по стандартних буферних розчинах.
8.1. Підготовка приладу до роботи:
- натиснути кнопки "t" і "-1/19". Прогріти прилад протягом 30 хв
- зібрати гальванічне коло з електрода визначення і електрода порівняння. Електродом визначення є скляний електрод з Н+ функцією, електродом порівняння (допоміжним) – хлорсрібний електрод (ЭВЛ-ІМ) із сталим значенням потенціалу 0,201 В. Електроди підключити у відповідні гнізда на задній панелі приладу;
- встановити електроди у спеціальний утримувач над магнітною мішалкою. Титрування проводити у стаканчику місткістю 50 см3, де знаходиться магнітна вертушка для перемішування;
- натиснути кнопки "аніони/катіони", "рХ" та кнопку діапазону рН"4/9".
8.2. Визначення буферної ємності по кислоті (Вк).
Піпеткою відібрати 20,0 мл сироватки крові, перенести у стаканчик з магнітною вертушкою. Бюретку заповнити титрованим розчином соляної кислоти. Визначити первинне значення рН - рНо. При перемішуванні додати розчин кислоти до зміни рН приблизно на одиницю. Визначити на приладі точне значення рН, що встановилося, а по бюретці - точний об’єм кислоти, що був витрачений.
Буферну ємність розрахувати за формулою:
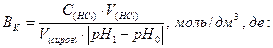
С(НСl) , V(HCl) – молярна концентрація еквівалента (моль/дм3) і об'єм (мл) розчину соляної кислоти;
V(сиров) - об’єм сироватки крові (мл);
|рН1 – рН0| - різниця значень рН по абсолютній величині.
8.3. Визначення буферної ємності по лугу (Вл).
Відібрати піпеткою 20,0 мл сироватки крові. Бюретку заповнити титрованим розчином гідроксиду натрію. Титрування проводити аналогічно попередньому. Визначити нове значення рН сироватки крові та витрачений об’єм розчину гідроксиду натрію. Виконати розрахунок за формулою:

С(NaOH), V(NaOH) – молярна концентрація еквівалента (моль/дм3) і об’єм (мл) розчину гідроксиду натрію;
V(сиров) – об’єм сироватки крові, мл;
|pH1 – рН0| - різниця значень рН по абсолютній величині.
8.4. Оформлення протоколу лабораторної роботи.
Зробити розрахунки буферної ємності по кислотіталугу, порівняти одержані значення і записати висновки.
9. ЛІТЕРАТУРА.
1. 1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 170-176.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я.
Биофизическая химия. К, Вища школа, с.80-90, 123-126.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высшая школа, 1975. с. 96-100.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 601; Нарушение авторских прав?; Мы поможем в написании вашей работы!