
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль 2. 1 страница. Рівноваги в біологічних системах на межі поділу фаз
|
|
|
|
Рівноваги в біологічних системах на межі поділу фаз.
ЗАНЯТТЯ №1.
1. ТЕМА. Теплові ефекти хімічних реакцій в розчинах.
Направленість процесів.
2. ОБҐРУНТУВАННЯ ТЕМИ. Біоенергетика вивчає перетворення енергії, що відбуваються в організмі. Основним джерелом енергії для організму є хімічна енергія продуктів харчування. Вона витрачається на внутрішні процеси: дихання, кровообіг, метаболізм, секрецію, підтримування сталої температури, а також на виконання зовнішньої роботи. Незважаючи на цілий ряд особливостей енергообміну в організмі, теоретичною основою біоенергетики є хімічна термодинаміка з її законами і поняттями. А термохімія, як складова частина термодинаміки, дозволяє визначати калорійність продуктів харчування, тобто є важливою для дієтології та лікувального харчування, для встановлення норм харчування людей у залежності від їх енерговитрат. Закони і методи термохімії застосовуються для вивчення теплових ефектів біохімічних реакцій.
3. МЕТА. Сформувати уявлення про важливість термодинамічного підходу при дослідженні хімічних та біохімічних процесів. Засвоїти основні поняття термохімії. Опанувати методику найпростіших термохімічних досліджень та розрахунків.
Студент повинен знати:
- суть І і ІІ законів хімічної термодинаміки;
- закон Гесса та його наслідки;
- значення закону Гесса для прямої та непрямої калориметрії;
- суть понять: ентальпія, внутрішня енергія, ентропія;
- суть поняття "енергія Гіббса", "енергія Гельмгольца";
- термодинамічні критерії самодовільного перебігу хімічних і біохімічних реакцій;
- суть понять "макроергічні зв’язки", "макроергічні сполуки" і їх значення для живих організмів;
|
|
|
- суть понять "екзергонічні та ендергонічні процеси", "енергетичне супряження в живих організмах";
вміти:
- складати термохімічні рівняння екзо- та ендотермічних реакцій;
- розраховувати теплові ефекти реакцій за значеннями стандартних ентальпій утворення та згоряння;
- визначати калорійність харчових продуктів за значеннями калорійності білків, жирів, вуглеводів;
- розраховувати величину зміни енергії Гіббса для реакції за значеннями зміни ентальпії та ентропії;
- оцінювати можливість самодовільного перебігу процесів за значеннями зміни енергії Гіббса або зміни ентальпії та ентропії реакції;
оволодіти навичками:
- проведення найпростіших термохімічних визначень та розрахунків.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДНІ
ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про теплові ефекти реакцій, ендо- та екзотермічні реакції.
2) Складання рівнянь хімічних реакцій.
3) Суть реакції нейтралізації.
4) Вміння визначати температуру розчинів за допомогою термометра.
(Матеріал шкільного курсу з хімії)
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.

 Хімічна термодинаміка
Хімічна термодинаміка
 |  |

 Предмет і основні І закон термодинаміки ІІ закон поняття термодинаміки
Предмет і основні І закон термодинаміки ІІ закон поняття термодинаміки
 Термохімія
Термохімія
Енергія Гіббса

 Закон Гесса та Пряма і непряма його наслідки калориметрія
Закон Гесса та Пряма і непряма його наслідки калориметрія
 Критерії направленості при визначенні самодовільних процесів калорійності
Критерії направленості при визначенні самодовільних процесів калорійності
продуктів харчування
 Особливості термодинаміки Термохімічні
Особливості термодинаміки Термохімічні
 живого організму як відкритої рівняння
живого організму як відкритої рівняння
системи Розрахунок калорійності
продуктів харчування
Визначення теплового ефекту реакції нейтралізації та
складання термохімічного рівняння цієї реакції.
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Хімічна термодинаміка як наука. | 1.1. Предмет хімічної термодинаміки. 1.2. Основні поняття: - системи, види систем; - параметри системи; - ізобарні, ізохорні, ізотермічні процеси. |
| 2. І закон термодинаміки. | 2.1. Теплота і робота як форми перетворення різних видів енергії. 2.2. Суть понять: внутрішня енергія, ентальпія. |
| 3. Термохімія як наука про теплові ефекти хімічних реакцій. | 3.1. Зміна ентальпії як тепловий ефект реакції. 3.2. Термохімічні рівняння, система знаків теплових ефектів. 3.3. Розрахунки за термохімічними рівняннями. |
| 4. Закон Гесса та його наслідки. | 4.1. Суть закону Гесса та застосування його для розрахунків. 4.2. Стандартні ентальпії (теплоти) утворення і згоряння та їх застосу-вання для розрахунків теплових ефектів реакцій. 4.3. Пряма та непряма калориметрія при визначенні калорійності харчових продуктів. |
| 5. ІІ закон термодинаміки. | 5.1. Ентропія та її зміна у самодовільному процесі. 5.2. Якісна оцінка зміни ентропії у хімічних реакціях. |
| 6. Термодинамічні потенціали: енергія Гіббса та енергія Гельмгольца. | 1.1. Розрахунок зміни енергії Гіббса у реакції за даними стандартних енергій Гіббса вихідних речовин і продуктів реакції. |
| 7. Критерії направленості самодовільних процесів. | 2.1. Ентальпійні та ентропійні фактори у хімічних реакціях. 2.2. Зміна енергії Гіббса як критерій самодовільного перебігу хімічного процесу. |
| 8. Особливості термодинаміки живого організму як відкритої системи. | 3.1. Макроергічні сполуки у живому організмі. АТФ як джерело енергії. 3.2. Енергетичне супряження екзергонічних та ендергонічних процесів в організмі. 3.3. Поняття про стаціонарний стан відкритої системи. |
|
|
|
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вказати, в якому випадку реакція е ендотермічною.
а) якщо енергія продуктів дорівнює енергії вихідних речовин;
б) якщо енергія продуктів більша, ніж енергія вихідних речовин;
в) якщо енергія продуктів менша, ніж енергія вихідних речовин;
г) це можна зробити, якщо відомо, виділяється теплота, чи поглинається.
2) Вибрати термохімічні рівняння екзотермічних реакцій:
а) О2 + 1/2 О2 = О3, DН = 142 кДж
б) 1/2 О2 + Н2 = Н2О (г), DН= - 242 кДж
в) Н2О + 1/2 О2 = Н2О2, DН = 98,2 кДж
г) Н2 + 1/2 О2 = Н2О (г), DН = - 285,8 кДж
|
|
|
3) Вказати, для якої з речовин стандартна ентальпія утворення дорівнює нулю.
а) Вr2 г) б) Вr2 (p) в) Вr2 (т) г) НBr (г)
4) Розрахувати зміну ентальпії DН (тепловий ефект) реакції, яку експериментально здійснити неможливо: Н2 (г)+ 02 (г)= Н202 (г), якщо відомі такі термохімічні рівняння:
Н2О2 (р) = Н2О (р) + 1/2 О2 (г), DН = -98,2 кДж (І)
Н2 (г) + 1/2 О2 (г) = Н2О (р), DН = -284,2 кДж (ІІ)
а) -382,4 кДж; б) -186,0 кДж; в) 186,0 кДж; г) 382,4 кДж
5) Розрахувати кількість теплоти, що виділяється у реакції:
С(т) + 2N2O (г) = CO2(г) + 2N2(г),
якщо вступає в реакцію 22 г оксиду нітрогену (І), а ентальпії утворення дорівнюють:
DН0f,298(N2O(r)) = 81,55 кДж/моль, DН0f,298(CO2 (r)) = -393,51 кДж/моль
а) 475,1 кДж б) 139,2 кДж в) 278,3 кДж г) 556,61 кДж
6) Визначити якісну величину (знак) зміни ентропії у реакціях:
1. 2C (т) + O2 (г) = 2CO (г) 2. 2H2 (г) + O2 (г) = 2H2O (г)
а) 1. DS > 0 б) 1. DS < 0 в) 1. і 2. DS > 0
2. DS < 0 2. DS >0 г) 1. і 2. DS < 0
7) Розрахувати калорійність 200 г маргарину, що містить 0,3% білків, 82,3% жирів, 1%вуглеводів, якщо при згорянні в організмі 1 г білка або 1 г вуглевода виділяється 17,18 кДж енергії, а при згорянні 1 г жиру виділяється 38,97 кДж енергії.
8) Визначити умови зміни ентальпії і зміни ентропії реакції, за якими вона буде відбуватися самодовільно за будь-якої температури.
а) ΔН>0, ΔS>0 б) ΔН<0, ΔS<0 в) ΔН>0, ΔS<0 г) ΔН<0, ΔS>0
9) Оцінити, за якої температури буде відбуватися самодовільно процес, термохімічне рівняння для якого має вигляд:
2 С(т) + 02 (г) = 2 СО(г), ΔН° = - 221 кДж,
якщо відомі значення стандартних ентропій речовин:
S0298(C(т))= 5,74 Дж/моль × К; S0298(О2(г))= 205,17 Дж/моль × К;
S0298(CО(г))= 197,68 Дж/моль × К
а) буде відбуватися тільки за стандартної температури;
б) буде відбуватися за будь-якої температури;
в) не буде відбуватися за стандартної температури;
г) не буде відбуватися за будь-якої температури.
ПРАВИЛЬНІ ВІДПОВІДІ.
1) Правильна відповідь б).
Ендотермічною є реакція, яка супроводжується поглинанням теплоти, тому енергія продуктів буде більша, ніж енергія вихідних речовин.
2) Правильна відповідь б) і г).
Екзотермічні реакції супроводжуються виділенням теплоти, отже, для них зміна ентальпії буде від’ємною (термодинамічна система знаків теплових ефектів).
|
|
|
3) Правильна відповідь б).
Стандартна ентальпія (теплота) утворення ( DН0f,298 ) дорівнює нулю для простих речовин, якщо вони за стандартних умов знаходяться у стійкому стані. Простою речовиною, з наведених у відповідях, є бром. Але стійким станом за стандартних умов для нього є рідина, отже тільки для Вr2 (р) DН0f,298 буде дорівнювати нулю.
4) Правильна відповідь б).
Для того, щоб одержати термохімічне рівняння потрібної реакції Н2 (г) + О2 (г) = Н2О2 (р), DН, тобто знайти величину DН, треба від рівняння (ІІ) відняти рівняння (І) і від DН2 відняти DН1:
Н2 (г) + 1/2 О2 (г) - Н2О2 (р) = Н2О(р) - Н2О(р) – 1/2 О2(г), DН = DН2 -DН1
або Н2 (г) + 1/2 О2 (г) + 1/2 О2 (г) = Н2О2 (р), DН = -284,2-(-98,2)
Маємо: Н2 (г) + О2 (г) = Н2О2 (р), DН = - 186,0 кДж
5) Правильна відповідь б).
Запишемо термохімічне рівняння реакції:
С(т) +2N2O = CO2(г) + 2N2(г), ΔН =...
Розрахуємо значення теплового ефекту за наслідком закону Гесса, що був використаний при розв’язанні попередньої задачі, та значеннями стандартних ентальпій утворення за умовою. Пригадаємо, що для С(т) і N2(г) стандартні теплоти утворення дорівнюють нулю.
Отже, будемо мати:
ΔН =DН0f,298(СО2(г))-2 × DН0f,298(N2О(г)) =-393,51 – 2 × (81,55) = - 556,61(кДж).
Тобто, термохімічне рівняння матиме таку повну форму:
С(т) + 2N2О(г) = СО2(г) + 2N2(г), ΔН = -556,61 кДж.
Якщо в реакцію вступає 22 г N2О (або 0,5 моль, бо М(N2О)= 44 г/моль), у реакції буде виділятися у чотири рази менше тепла:
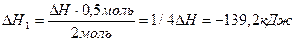
6) Правильна відповідь а).
У цілому величина ентропії речовини залежить від її агрегатного стану і зменшується в ряду: газ - рідка речовина - тверда речовина. Для якісної оцінки зміни ентропії у хімічній реакції можна з певним припущенням порівнювати кількість тільки газоподібної речовини до і після реакції. Чим більшою буде кількість таких речовин, тим більшою буде і величина ентропії.
Застосовуючи такий підхід, маємо для першої реакції: у лівій частині рівняння 1 моль газу, а у правій - 2 моль, отже ΔS>0. У другій реакції справа буде менше газоподібних речовин, ніж зліва, тобто ΔS<0, бо завжди ΔS =SS(продуктів)- SS (вих. речовин)
7) Знаходимо масу білків, жирів і вуглеводів у маргарині:
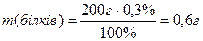
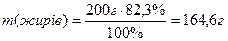
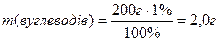
Враховуючи калорійність 1 г білків, жирів і вуглеводів, знаходимо загальну калорійність 200 г маргарину:
Q = (0,6 г + 2,0 г) × 17,18 кДж/г + 164,6 г × 38,97 кДж/г = 44,67 кДж + 6414,46 кДж = = 459,13 кДж
Отже, при повному окисленні 200 г маргарину організм одержить 6459 кДж енергії.
8) Правильна відповідь г).
Як відомо, реакція легко відбувається самодовільно, якщо виконується критерій самодовільного перебігу реакцій, а саме: ΔG<0. Оцінити знак зміни енергії Гіббса можна за знаками зміни ентальпії і зміни ентропії реакції за рівнянням:
ΔG = ΔН – Т × ΔS
Отже, для того, щоб значення ΔG було від’ємним незалежно від температури, треба, щоб виконувалися умови: ΔΗ<0 і ΔS>0
9) Правильна відповідь б).
Оскільки відомі величини зміни ентальпії реакції (ΔН = -221кДж), треба розрахувати величину ентропії. Зміна ентропії реакції ΔS° розраховується як різниця суми стандартних ентропій продуктів реакції і суми стандартних ентропій вихідних речовин з урахуванням їхніх коефіцієнтів:
ΔS=2 × SO298(CO2(r)) - 2 × SO298(C(T)) -2 × SO298(O2(r))= 2 × 196,68 – 2 × 5,74 – 205,17 = 395,36 – -11,48 – 205,17 = 178,71 (Дж/К)
Тепер визначаємо зміну енергії Гіббса реакції:
ΔG° = ΔΗ° - 298 × ΔS = - 221 – 298 × 0,1787 = - 274,25 (кДж)
Оскільки ΔG°<0, можна зробити висновок, що за стандартної температури реакція буде йти самодовільно, але, враховуючи, що ΔН°<0 і ΔS°>0, треба оцінити цю реакцію як самодовільну, з термодинамічної точки зору, за будь-якої температури.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Визначення величини теплового ефекту реакції нейтралізації.
Для вимірювання теплових ефектів реакцій використовують калориметри. У цій роботі визначення будуть проводитися за допомогою найпростішого калориметра, який складається з двох фарфорових стаканів - внутрішнього і зовнішнього, прошарок повітря між якими єтеплоізолятором. Припустимо, що теплота нейтралізації буде витрачатися на нагрівання розчину, що утвориться при реакції, і внутрішнього стакана, маса якого (m ст) відома.
Відібрати мірним циліндром 100 мл розчину NаОН (молярна концентрація 1 моль/л) і вилити у внутрішній стакан. Занурити у цей розчин термометр, витримати 1-2 хв. і визначити температуру (t1). Припускаючи, що розчин кислоти має таку ж саму температуру, відібрати 100 мл розчину НСl (молярна концентрація 1 моль/л) і швидко влити її у той же самий стакан. За допомогою термометра визначити максимальну температуру розчину, що утворився (t2).
Припускаючи, що густина розчинів гідроксиду натрію і соляної кислоти однакова і дорівнює 1 г/мл, будемо мати таку масу розчину у стакані:
m р = (VNаОН +VHCl) × r = (100 + 100) × 1 = 200 (г).
Значення m ст, t1 і t2 занести у таблицю:
| Параметр | Позначення | Величина |
| 1. Маса внутрішнього стакана | m ст | |
| 2. Маса розчину | m р | 200 г |
| 3. Теплоємність стакана | С ст. | 1,087 Дж/г × град |
| 4. Теплоємність розчину | С р. | 4,1 Дж/г × град |
| 5. Початкова температура | t1 | |
| 6. Кінцева температура | t2 |
Розрахувати суму теплоємностей (SC) стакану і розчину в ньому:
SC = Cст. ×mст.+ Ср. × mр, Дж/град.
Визначити кількість теплоти, що виділяється у досліді:
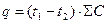 , Дж
, Дж
Визначити кількість теплоти, що відповідає взаємодії 1 моль гідроксиду натрію з 1 моль хлороводневої кислоти, враховуючи, що у 100 мл розчину NaOH і НСl міститься по 0,1 моль речовини:
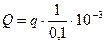 , кДж
, кДж
8.2. Складання термохімічного рівняння реакції нейтралізації. Записати термохімічне рівняння реакції нейтралізації у молекулярній і короткій іонній формах за термодинамічною системою знаків теплових ефектів, враховуючи, що Н = - Q.
8.3. Оформлення протоколу лабораторної роботи.
Записати у зошит необхідні розрахунки по визначенню теплового ефекта реакції нейтра-лізації, заповнити таблицю, записати термохімічне рівняння реакції нейтралізації у моле-кулярній і короткій іонній формах
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с.366-411.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянський В.Г., Цыганенко А.Я. Биофизическая химия. К., Вища школа, 1986, с. 8-25.
4. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М., Высшая школа, 1989, с. 6-28.
5. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высшая школа, 1975, с.10-17.
ЗАНЯТТЯ № 2
1.ТЕМА. Кінетика біохімічних реакцій.
2. ОБҐРУНТУВАННЯ ТЕМИ. Хімічна кінетика є основою для вивчення швидкостей та механізму біохімічних реакцій. Дослідження швидкостей біохімічних реакцій дозволяють визначити активність ферментів, що допомагає встановити правильний діагноз. Користуючись методами хімічної кінетики, можна визначити швидкість надходження лікарських речовин у кров та виведення їх з організму. Знання періоду напівперетворення потрібне для встановлення терміну зберігання лікарських засобів, швидкості накопичення у довкіллі радіонуклідів, пестицидів, інших шкідливих речовин. Методи хімічної кінетики дають змогу обрати оптимальні умови для нейтралізації та утилізації шкідливих викидів промислових підприємств, контролювати рівень забруднення водосховищ і водоймищ стічними водами та нафтопродуктами, а повітря - отруйними газами. Вивчення теоретичних положень хімічної кінетики дозволить студентам засвоїти відповідні розділи біохімії, фармакології, гігієни.
3. МЕТА. Засвоїти теоретичні положення хімічної кінетики як основи для вивчення механізму і швидкості хімічних і біохімічних реакцій. Експериментально довести залежність швидкості реакції від концентрації та температури.
Студент повинен знати:
- визначення швидкості реакції;
- закон діючих мас для швидкості реакції, особливості його застосування для гомогенних і гетерогенних реакцій, фізичний зміст константи швидкості реакції;
- суть понять "молекулярність" і "порядок реакції";
- правило Вант-Гоффа, його особливості для біохімічних процесів;
- суть поняття "енергія активації", рівняння Арреніуса, поняття про теорію перехідного
стану;
- визначення і приклади простих і складних реакцій, ланцюгових реакцій, антиоксидантів.
вміти:
- складати кінетичні рівняння за законом діючих мас для гомогенних і гетерогенних реакцій;
- визначати формальний загальний порядок реакції за кінетичним рівнянням;
- оцінювати зміну швидкості реакції в залежності від зміни концентрації і тиску реагуючих речовин;
- проводити розрахунки за правилом Вант-Гоффа.
оволодіти навичками:
- експериментального доведення впливу концентрації та температури на швидкість реакції.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Гомогенні та гетерогенні реакції.
2)Поняття про середню швидкість реакції.
(Матеріал шкільної програми зхімії).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.

 Хімічна кінетика
Хімічна кінетика
 Швидкість реакції Механізм реакції
Швидкість реакції Механізм реакції

 Закон діючих мас
Закон діючих мас

Константа Залежність Молекулярність Теорія Складні
швидкості швидкості і порядок реакції перехідного реакції
від концентрації стану

 і температури
і температури

Визначення залежності Правило Вант-Гоффа. Енергія активації. швидкості реакції від Температурний кое- Рівнння Арреніуса концентрації і фіцієнт швидкості температуриі реакції
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Швидкість хімічних реакцій. | 1.1. Середня швидкість. 1.2. Миттєва швидкість. |
| 2. Закон діючих мас для швидкості реакції. | 2.1. Особливості застосування закону для гомогенних і гетерогенних, простих і складних реакцій. 2.2. Фізичний зміст константи швидкості. 2.3. Залежність швидкості реакції від концентрації, тиску, температури. |
| 3. Молекулярність і порядок реакції. | 3.1. Реакції нульового, першого порядку. 3.2. Поняття про механізм реакції. Теорія перехідного стану. |
| 4. Залежність константи швидкості реакції від температури. | 4.1. Поняття про енергію активації. 4.2. Рівняння Арреніуса. 4.3. Правило Вант-Гоффа. Температурний коефіцієнт швидкості реакції, його особливості для біохімічних процесів. |
| 5. Поняття про складні реакції. | 5.1. Паралельні, послідовні, оборотні, супряжені реакції. 5.2. Ланцюгові реакції. Поняття про антиоксиданти. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вибрати з наведених реакцій ті, що є гетерогенними:
1. 2 СО(г) + О2(г) = 2 СО2(г) 2. S(т) + О2(г) = SО2(г)
3. 2 Na(т) + Сl2(г) = 2NаСl(т) 4. Nа2СO3(т) + SiО2(т) = Na2SiO3(т) + CO2(г)
а) 1, 2, 3 б) 2, 3, 4 в) 1, 3, 4 г) 1, 2, 4
2) Вказати, від яких факторів залежить константа швидкості реакції.
а) від температури і концентрації;
б) від природи реагуючих речовин і їх концентрації;
в) від природи реагуючих речовин і температури;
г) від природи реагуючих речовин, температури і концентрації.
3) Вибрати правильне кінетичне рівняння для реакції:
CaCО3(г) = СаО(т) + СО2(г)
а) v = k × [СаСО3] б) v = k × [CaO] × [CO2] в) v = k × [СО2] г) v = k
4) Визначити, як зміниться швидкість реакції 2NO(г)+O2(г) = 2NO2(г) , якщо зменшити реакційний об’єм у 3 рази.
а) зменшиться у 9 разів; в) зменшиться у 27 разів;
б) збільшиться у 9 разів; г) збільшиться у 27 разів.
5) Вказати величину загального порядку реакції: 2NO(г)+ O2(г) = 2NO2(г)
а) 5 б) 3 в) 2 г) 1
6) Розрахувати, у скільки разів зросте швидкість реакції при підвищенні температури з 20 до 70°С, якщо температурний коефіцієнт швидкості реакції дорівнює 3.
а) 15 б) 81 в) 243 г) 729
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь б).
Гетерогенними називаються реакції, реагуючі речовини яких знаходяться у різних фазах. Це реакції між газом і рідиною, газом і твердою речовиною, двома рідинами, що не змішуються, або двома твердими речовинами, які завжди утворюють дві різні фази.
2) Правильна відповідь в).
Константа швидкості реакції залежить лише від природи реагуючих речовин і температури, вона дорівнює швидкості реакції за умови одиничних концентрацій реагуючих речовин.
3) Правильна відповідь г).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 647; Нарушение авторских прав?; Мы поможем в написании вашей работы!