
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи добування. Основним методом добування солей діазонію є реакція діазотування первинних ароматичних амінів
|
|
|
|
Основним методом добування солей діазонію є реакція діазотування первинних ароматичних амінів.
1. Дія нітритної кислоти. Нітритну кислоту добувають безпосередньо в процесі діазотування. Весь процес відбувається при охолодженні (не вище +5°С), щоб уникнути розкладання діазосполук:

Аміни діазотуються тим легше, чим вища їх основність.
22.3.3. Фізичні властивості
Солі діазонієвих основ легкорозчинні у воді, в розчинах, що мають нейтральну реакцію вони повністю дисоційовані на йони. У спирті й оцтовій кислоті солі діазонію слабо розчинні і виділяються в кристалічному стані.
22.3.4. Хімічні властивості
І. Реакції діазосполук з виділенням азоту можуть відбуватися або за гетеролітичним (іонним) або за гемолітичним (радикальним) механізмом.
1. Термічне розкладання за наявності води і спиртів відбувається за механізмом SN1 у дві стадії:

Далі швидко відбувається взаємодія з нуклеофілом:

Діазозалишок заміщується на гідроксил у водному розчині вже за кімнатної температури (реакція значно пришвидшується під час нагрівання). Взаємодія зі спиртами під час кип'ятіння розчину може йти в двох напрямках: у бік окиснення спирту до альдегіду або в бік утворення етеру фенолу:

2. Заміщення діазогрупи на Іод здійснюється обробкою розчину солі діазонію на холоді калій іодидом з наступним нагріванням суміші:

3. Реакції Зандмейєра — заміщення діазогрупи на Хлор, Бром, ціаногрупу:

ІІ. Реакції діазосполук без виділення азоту.
1. Відновлення (добування арилгідразинів):

Відновником є ZnCl2 у хлоридній кислоті або натрій гідросульфіт.
2. Реакції азосполучення є основним методом синтезу азосполук. Це взаємодія солей діазонію (слабких електрофілів) з фенолами або ароматичними амінами, тобто нуклеофільними реагентами, які містять сильні електронодонорні угруповання (–ОН, –NH2, –NHR, –NR2)і виявляють високу активність до реакцій електрофільного заміщення. Сіль діазонію в цій реакції називається діазоскладовою (діазокомпонентом), а фенол чи ароматичний амін, який сполучається з нею, — азоскладовою (азокомпонентом). Реакція азосполучення за цим механізмом є типовою реакцією електрофільного заміщення в ароматичному кільці сполуки з електронодонорним замісником (аміну чи фенолу) – SN2-реакція, внаслідок якої з відносно нестійкої діазосполуки утворюється стійка азосполука. Атака електрофілу відбувається майже виключно в пара -положення до електронодонорного замісника (гідрокси- чи аміногрупи), а коли воно зайняте, тоді — в орто -положення.
Для кожної реакції існує певне оптимальне значення рН. Практично сполучення фенолів здійснюють у слаболужному середовищі, де негативно заряджений атом Оксигену фенолят-аніона активує ароматичне кільце сильніше, ніж гідроксил самого фенолу, що є важливим для електрофільної атаки кільця катіоном діазонію:

Аміни сполучаються з солями діазонію в нейтральних і слабокислих середовищах (третинні аміни — у більш кислих середовищах):

На електрофільну активність діазокатіона істотно впливає наявність в ароматичному кільці, особливо в пара- або орто -положеннях, електроноакцепторних замісників, які зменшують електронну густину бензенового кільця, тим самим збільшують позитивний заряд діазогрупи і підвищують електрофільну активність діазосполук.
Деякі азобарвники, в певних межах рН, здатні змінювати своє забарвлення і тому можуть використовуватись як кислотно-основні індикатори. Одним із найпоширеніших індикаторів є метилоранж (геліантин, оранжевий III), який добувають сполученням діазотованої сульфанілової кислоти з диметиланіліном. Він має жовтий колір у нейтральному і лужному середовищах та рожево-червоний — у кислому. Як і в інших індикаторів такого типу, зміна забарвлення в нього зумовлена таутомерним переходом від азоїдної (Na — сіль) до хіноїдної форми (вільна кислота):
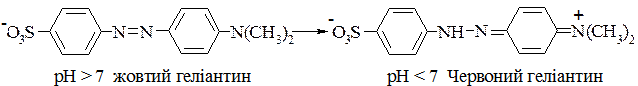
Для застосування в харчовій промисловості азобарвники непридатні, оскільки мають канцерогенну дію.
22.4. Амінокислоти
Амінокислотами називаються гетерофункціональні сполуки, які містять у молекулах одночасно амінні й карбоксильні групи. Отже, амінокислоти можна розглядати як карбонові кислоти, у вуглеводневих залишках яких один або кілька атомів Гідрогену заміщені на аміногрупи.
22.4.1. Класифікація
1. Залежно від кількості функціональних груп розрізняють:
а) моноаміномонокарбовові кислоти (одна група –NH2, одна –СООН), або нейтральні амінокислоти; б) діаміномонокарбонові (дві групи –NH2, одна
–СООН), або основні амінокислоти; в) моноамінодикарбонові (одна група
–NH2, дві –СООН), або кислі амінокислоти; г) діамінодикарбонові кислоти (дві групи –NH2, дві –СООН) тощо.
2. Залежно від характеру вуглеводневого залишку амінокислоти поділяють на аліфатичні, ароматичні й гетероциклічні.
3. Залежно від розміщення аміногрупи відносно карбоксилу в головному ланцюгу розрізняють α-, β-, γ- і т.д. до ω-амінокислот (у молекулах
ω-амінокислот карбоксил і аміногрупа розміщені на протилежних кінцях карбонового ланцюга).
4. Особливо виділяються амінокислоти, що містять у своїх молекулах, крім –NH2 і –СООН, інші функціональні групи — гідроксигрупу –ОН (гідроксивмісні), тіольну групу –SH та алкіловану –S–R(сульфуровмісні), амідну групу –CONH2 тощо.
5. Оскільки амінокислоти відіграють виключно важливу роль у процесах життєдіяльності, то у біоорганічній хімії їх поділяють на синтетичні і природні. Серед природних, у свою чергу, розрізняють ті, що входять до складу білків (протеїногенні), іті, що до складу білків не входять (непротеїногенні), а також окремо виділяють так звані незамінні амінокислоти, які необхідні тваринному організму, але не можуть у ньому синтезуватись.
Зараз відомо більше як 150 природних амінокислот, з них 26 виявлено в складі білків, 10 амінокислот є незамінними.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2156; Нарушение авторских прав?; Мы поможем в написании вашей работы!