
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова молекул
|
|
|
|
У вільному стані в розчинах карбоксил, який має кислотні властивості, та аміногрупа, яка має основні властивості, вступають у внутрішньомолекулярну взаємодію, внаслідок чого утворюється внутрішня сіль (біполярний йон):

22.4.6. Фізичні властивості
Фізичні властивості амінокислот дещо нетипові для органічних сполук, зумовлені саме цією особливістю будови їх молекул — існуванням у формі біполярного йона (цвіттер-іона). Завдяки йонній будові амінокислоти добре розчинні у воді та погано — в органічних розчинниках.
22.4.7. Хімічні властивості
1. Кислотно-основні властивості. Оскільки в молекулах амінокислот містяться одночасно основна, і кислотна групи, ці сполуки мають амфотерний характер. У кислих розчинах вони виявляють основні властивості, а в лужних реагують як кислоти, утворюючи відповідно дві групи солей:
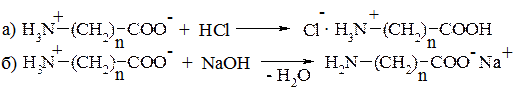
2. Реакції карбоксильної групи практично не відрізняються від аналогічних властивостей звичайних карбонових кислот. До них належать утворення: а) солей з основами; б) галогенангідридів; в) естерів та ін.
3. Реакції амінної групи аналогічні відповідним реакціям амінів:
а) утворення солей з кислотами; б) ацилювання; в) алкілювання;
г) взаємодія з нітритною кислотою.
Карбоксильна й амінна групи, особливо якщо вони перебувають в
α-положенні, істотно впливають одна на другу. Перерозподіл електронної густини, який відбувається у цьому разі в молекулі, зумовлює активацію функціональних груп і спричинює ряд специфічних реакцій амінокислот, що наведені далі.
4. Декарбоксилювання відбувається легше, ніж у карбонових кислот:
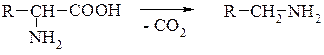
Процес декарбоксилювання α-амінокислот поширений у живих організмах і зумовлює утворення біогенних амінів.
5. Перетворення амінокислот під час нагрівання.
А. α-Амінокислоти утворюють циклічні аміди (пептиди) — дикетопіперазини:
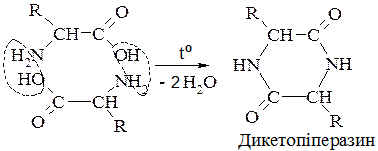
Б. β-Амінокислоти під час нагрівання утворюють α-, β-ненасичені кислоти (подібно до β-гідргідроксикислот):
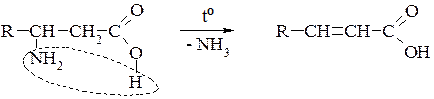
В. γ- δ - і ε- Амінокиспоти утворюють внутрішні циклічні естери — лактами:
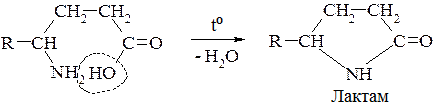
6. Утворення комплексних сполук з гідроксидами важких металів, зокрема з гідроксидом купруму, темно-синього або синьо-фіолетового забарвлення використовують як якісну реакцію на α-амінокислоти (аналогічно реакції з етиленгліколем):
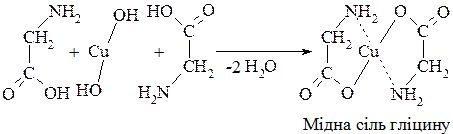
7. Здатність до поліконденсації є однією з найважливіших хімічних властивостей амінокислот, де в хімічній взаємодії беруть участь обидві функціональні групи — амінна та карбоксильна. Залежно від кількості молекул амінокислоти, що беруть участь у поліконденсації, можуть утворюватись пептиди з різною кількістю амінокислотних залишив, від 2 до n:

Угруповання 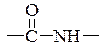 називається пептидною групою, або пептидним зв'язком.
називається пептидною групою, або пептидним зв'язком.
22.4.8. Окремі представники
Гліцин (глікокол, амінооцтова кислота) NН2–СН2–СООН – має солодкий смак, якому завдячує своєю назвою (від грец. γλυκυς — солодкий, коλλα — клей). Безбарвна, кристалічна речовина розчиняється у воді і не розчиняється в етері, солодка на смак, оптично неактивна. Це перша амінокислота, виділена при гідролізі білків. У великій кількості міститься в желатині, білках натурального шовку (~ 36% сухої маси), м'язах нижчих тварин, цукровому буряку. Гліцин добувають кип’ятінням желатину з розбавленою сульфатною кислотою або баритовою водою.
Бетаїн існує лише у вигляді біполярного йона, є повністю метильованим гліцином (СНз)з+N–СН2–СОО–. Він входить до складу зерна та паростків рослин, у великій кількості міститься в гичці цукрового буряка, від якого дістав свою назву (від лат. Beta νulgaris — буряк звичайний).
Бетаїнаминазивають усі N- алкільовані похідні амінокислот, які дуже поширені в рослинному і тваринному світі. Прикладом бетаїну такого типу є моно- N -метилгліцин, або саркозин, СН3–NН–СН2–СООН. Він міститься в тканинах м’язів.
В наш час під бетаїнами розуміють внутрішні (інтермолекуляні) основи четвертинного амонію, Оксонію, Сульфонію та ін. Бетаїн бере участь в утворенні гемоглобіну, пуринів та порфінів, парних жовчних кислот, глутатіону, оцтової та мурашиної кислот, креатину, холіну, серину та саркозину. Міститься він у рослинних білках і у вільному стані в рослинах. Легко синтезується в організмі людини та більшості тварин. При дезамінуванні утворює не кетокислоту, а альдегідокислоту — гліоксалеву.
α-Аланін (α-амінопропіонова кислота)  – безбарвна речовина, існує в вигляді двох активних антиподів, β-аланін входить до складу вітаміну — пантотенової кислоти.
– безбарвна речовина, існує в вигляді двох активних антиподів, β-аланін входить до складу вітаміну — пантотенової кислоти.
L(+)Аланін входить до складу багатьох білкових речовин. D(-)Аланін, було знайдено в злоякісних пухлинах. При окиснювальному дезамінуванні він перетворюється в α-кетокислоту, яка внаслідок амінування перетворюється в L(+)амінокислоти.
Валін (α-аміноізовалеріанова кислота) 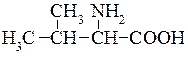 у невеликій кількості міститься майже в усіх рослинних білках, а також входить до складу тваринних білків (від 4 до 9%). Валін — незамінна амінокислота. В організмі людини та тварин вона не утворюється.
у невеликій кількості міститься майже в усіх рослинних білках, а також входить до складу тваринних білків (від 4 до 9%). Валін — незамінна амінокислота. В організмі людини та тварин вона не утворюється.
Лейцин (α-аміноізокапронова кислота)  міститься в гемоглобіні крові, альбуміні яйця, казеїні. Лейцин є незамінною амінокислотою, це білі блискучі лускоподібні кристали (від грецького слова лейкос – білий блискучий).
міститься в гемоглобіні крові, альбуміні яйця, казеїні. Лейцин є незамінною амінокислотою, це білі блискучі лускоподібні кристали (від грецького слова лейкос – білий блискучий).
Ізолейцин, (α-аміно-β-метилвалеріанова кислота)
 разом з лейцином міститься в багатьох білках. L(+)Ізолейцин знайдено в буряковій мелясі. Дріжджі при спиртовому бродінні поступово дезамінують і декарбоксилюють кислоти. Так, валін — джерело ізобутилового спирту, а ізолейцин — ізоамілового. Вони є складовою частиною сивушних масел у сирому спирті, який дістають з харчової сировини.
разом з лейцином міститься в багатьох білках. L(+)Ізолейцин знайдено в буряковій мелясі. Дріжджі при спиртовому бродінні поступово дезамінують і декарбоксилюють кислоти. Так, валін — джерело ізобутилового спирту, а ізолейцин — ізоамілового. Вони є складовою частиною сивушних масел у сирому спирті, який дістають з харчової сировини.
Лейцин і ізолейцин синтезуються в рослинах з α- кетоізовалеріанової та глутамінової кислот, в яких вони перебувають у зв’язаному та вільному станах, застосовуються при токсикозах, анемії, психічних розладах.
ε-Амінокапронова кислота NН2–СН2–СН2–СН2–СН2–СН2–СООН. Велике практичне значення має лактам (внутрішній циклічний амід) цієї кислоти — капролактам:

Капролактам є вихідною речовиною для виробництва синтетичної речовини тканини — капрону. Смолу капрон одержують полімеризацією капролактаму. Процес ведуть за наявності невеликої кількості води (каталізатор). Під її впливом цикл капролактаму розкривається і ланцюги
ε-амінокапронової кислоти з’єднуються, утворюючи капронову смолу.
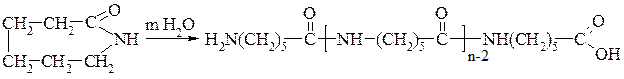
α-Амінодикарбонові кислоти.
Аспарагінова кислота (α-амінобурштинова кислота)

Глутамінова кислота (α-аміноглутарова кислота)
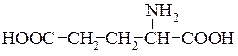
На відміну від одноосновних кислот вони мають добре виражені кислотні властивості. Обидві кислоти містяться у всіх рослинних білках і відіграють дуже важливу роль в обміні речовин у рослинних і тваринних організмах. Зв’язуючи амоніак в організмі, вони перетворюються в аспарагін та глутамін (аміди кислот). D- і L-Глутамінова кислота має надзвичайно велике значення для живого організму, вона виконує важливі біологічні функції, як основний продукт біохімічного переамінування, і як донор аміногруп при синтезі інших амінокислот.
Неповними амідами цих кислот є аспарагін та глутамін, які містяться в рослинах


Особливо поширений амід аспарагінової кислоти. L(-)Аспарагін, вперше було виділено з паростків спаржі (Asparagus – звідси і назва), багато його в пророщених у темряві рослин.
Одноосновні діамінокарбонові кислоти.
Лізин (α,ε-діамінокапронова кислота) 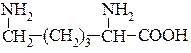 міститься в усіх білках, оптично активна, легко розчиняється у воді, одна з незамінних амінокислот для організмів людини і тварин. Він синтезується в рослинах, проте остаточно ще синтез не з’ясований. Трапляється як у зв’язаному, так і вільному стані. Впливає на нервову систему, калієвий обмін у тканинах, синтез гемоглобіну, утворення ДНК і РНК, процес пігментації та розвиток ембріону. Лізин міститься: в цибулі Каба та Батун, спаржі, шпинаті, горосі овочевому, квасолі, кукурудзі, винограді, малині, сливі Угорка, яблуках, грушах.
міститься в усіх білках, оптично активна, легко розчиняється у воді, одна з незамінних амінокислот для організмів людини і тварин. Він синтезується в рослинах, проте остаточно ще синтез не з’ясований. Трапляється як у зв’язаному, так і вільному стані. Впливає на нервову систему, калієвий обмін у тканинах, синтез гемоглобіну, утворення ДНК і РНК, процес пігментації та розвиток ембріону. Лізин міститься: в цибулі Каба та Батун, спаржі, шпинаті, горосі овочевому, квасолі, кукурудзі, винограді, малині, сливі Угорка, яблуках, грушах.
Серин (β-гідрокси-α-амінопропіонова кислота)  знайдена в рослинах, входить до складу білків. У казеїні молока або вітеліні жовтка міститься у вигляді естеру – серинфосфатної кислоти:
знайдена в рослинах, входить до складу білків. У казеїні молока або вітеліні жовтка міститься у вигляді естеру – серинфосфатної кислоти: 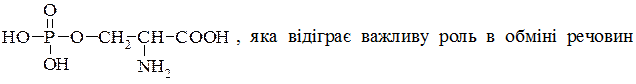 молодого тваринного організму.
молодого тваринного організму.
Серин утворюється з гліцину. Він є структурним елементом фосфатидів (серинфосфатидів) мозку та інших тканин та попередників коліну і коламіну у фосфатидах тваринного організму. При деркабоксилюванні серину утворюється коламін, який перетворюється на холін [OHСH2N(CH3)3]+OH–.
Треонін (β-гідрокси-α-аміномасляна кислота)  є незамінною амінокислотою, синтезується з аспарагінової кислоти, підвищує реакційну здатність білкової молекули. Треонін міститься у кератині – білку гусячого пір’я, в рослинах та мікроорганізмах. Його знайдено в цибулі, салаті, цвітній капусті, огірках, петрушці, квасолі, винограді, вишні, сливах і т.д.
є незамінною амінокислотою, синтезується з аспарагінової кислоти, підвищує реакційну здатність білкової молекули. Треонін міститься у кератині – білку гусячого пір’я, в рослинах та мікроорганізмах. Його знайдено в цибулі, салаті, цвітній капусті, огірках, петрушці, квасолі, винограді, вишні, сливах і т.д.
Сульфуровмісні амінокислоти.
Цистеїн (β-тіо-α-амінопропіонова кислота) 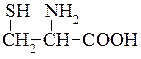 . При окисненні цистеїну киснем повітря утворюється дисульфід – цистин:
. При окисненні цистеїну киснем повітря утворюється дисульфід – цистин:

У живій клітині цистеїн легко перетворюється в цистин. Саме так легко відбувається зворотний процес. Ці перетворювання є окиснювально-відновлювальними процесами, які відбуваються в природі, цистеїн при цьому є відновником. У тваринному організмі цистеїн частково витрачається на утворення таурину, який бере участь в обміні жирів.
Цистин (диамінодитіокарбонова кислота) утворюється при окисненні цистеїну, а також із серину при заміні групи -OH на групу -SH та із вуглеводів.
Обидві амінокислоти входять до складу кератину шерсті. Волосся людини містить 13 – 14% цистину.
Дисульфідні зв’язки мають велике значення в утворенні третинної структури білків. Значна кількість цистину міститься в білках волосся, рогів і копит. При деяких захворюваннях цистин утворюється в сечовому міхурі і нирках. Він майже не розчинний у воді Тпл.=258 – 261°С.
Сульфуровмісні амінокислоти беруть участь у процесах знешкодження отруйних речовин, утворюючи з ними парні або етерсульфатні кислоти.
Метіонін (γ-тіометил-α-аміномасляна кислота)  – незамінна амінокислота.
– незамінна амінокислота.
У живих організмах метіонін виконує функцію метилюючого агента. Метіонін бере участь в утворенні та обміні холіну, креатину, вітаміну В12, фолієвої кислоти та гормонів. У разі нестачі метіоніну в організмі уражується підшлункова залоза, відбувається ожиріння печінки.
Метіонін міститься в капусті цвітній, цибулі, салаті, шпинаті, горосі консервованому, винограді, вишнях, яблуках, грушах.
Ароматичні амінокислоти.
Фенілаланін (α-аміно-β-фенілпропіонова кислота)

рослин. В живому організмі вона є біологічним попередником тирозину, її знайдено в цибулі, капусті кольрабі, огірках та ін.
Тирозин [ α-аміно-β- (n-гідроксифеніл) пропіонова кислота ]
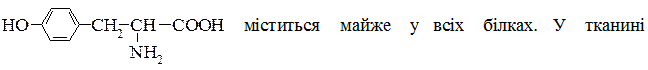 печінки вступає в реакцію переамінування з α-кетоглутаровою кислотою. Тирозин гідроксилюється до дигідроксифенілаланіну і через проміжні перетворення з нього утворюється адреналін (гормон кори надниркової залози) та норадреналін. Унаслідок виділення цих гормонів підвищується кров’яний тиск та вміст цукру в крові. Застосовується тирозин при захворюваннях на шизофренію та інших психічних розладах.
печінки вступає в реакцію переамінування з α-кетоглутаровою кислотою. Тирозин гідроксилюється до дигідроксифенілаланіну і через проміжні перетворення з нього утворюється адреналін (гормон кори надниркової залози) та норадреналін. Унаслідок виділення цих гормонів підвищується кров’яний тиск та вміст цукру в крові. Застосовується тирозин при захворюваннях на шизофренію та інших психічних розладах.
 стимулює ріст мікроорганізмів, сприяє росту шерсті у тварин. Вона є вихідною речовиною для синтезу ряду лікарських і фарбуючих речовин. Так, деякі її похідні мають анестезуючу дію і використовуються в медицині. Етиловий етер – під назвою анестезин і хлористоводнева сіль діетиламіноетилового етеру – новокаїн широко використовується в медицині, як активні анальгетики.
стимулює ріст мікроорганізмів, сприяє росту шерсті у тварин. Вона є вихідною речовиною для синтезу ряду лікарських і фарбуючих речовин. Так, деякі її похідні мають анестезуючу дію і використовуються в медицині. Етиловий етер – під назвою анестезин і хлористоводнева сіль діетиламіноетилового етеру – новокаїн широко використовується в медицині, як активні анальгетики.

Гетероциклічні амінокислоти.
Триптофан (α-аміно-β-індолілпропіонова кислота)
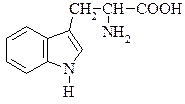
Знайдено майже в усіх білках і часто міститься в рослинах у вільному стані. В живому організмі триптофан не синтезується, проте бере участь в утворенні в живому організмі вітаміну РР, відсутність якого в харчах призводить до захворювання людини на пелагру. Триптофан – незамінна амінокислота, нестача його в їжі негативно позначається на стані організму тварин і людини. Триптофан під впливом гнильних бактерій при декарбоксилюванні перетворюється на отруйний триптамін, який окиснюючись, утворює індолілоцтову кислоту. При подальших перетвореннях утворюється скатол і, нарешті індол:
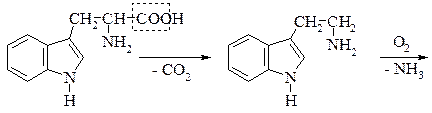
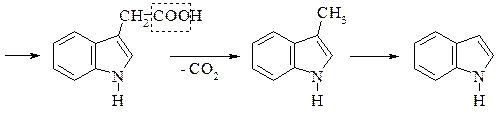
Скатол і індол значною мірою зумовлюють неприємний запах екскрементів.
22.5. Білки
Білки — це природні продукти макромолекулярної будови, що під час гідролізу перетворюються на суміш α-L-амінокислот, тобто білки є біополімерами α-L-амінокислот. Серед біоорганічних речовин білки посідають особливе місце, оскільки це основні структурні елементи органів і тканин, можуть виявляти ферментативну активність (ферменти), брати участь у регуляції метаболізму (гормони), процесах скорочення м'язів і руху, а також в імунних процесах.
У тваринних організмах білки становлять близько 50 % сухої маси. Незважаючи на різноманітність будови білків, їхній елементний склад змінюється незначною мірою (в % від сухої маси):
С — 51 – 55, О — 21 – 23, Н — 6,6 – 7,3, N — 15 – 18, S — 0,3 – 2,4. До складу деяких білків входить також Фосфор (0,2 – 2,0 %), Ферум та інші елементи.
Функціональні властивості білків визначаються послідовністю амінокислот у полімерному ланцюгу і конфігурацією, тобто просторовою структурою. З цієї точки зору розрізняють чотири рівні структурної організації молекули білка.
Первинна структура характеризує якісний і кількісний склад амінокислот і послідовність їх розміщення в пептидному ланцюзі білкової молекули. Основою первинної структури є пептидні зв'язки.
Вторинна структура визначає просторову конфігурацію поліпептидного ланцюга. Відомо три види вторинної структури: α-спіральна, β-складчаста і колагенова спіраль.
α - Спіраль — це правий гвинт, де наодин виток припадає 3 – 6 амінокислотних залишків β-Складчаста структура — це система паралельно й антипаралельно розміщених фрагментів. Складки виникають тому, що площини двох сусідніх зв'язків утворюють певний кут. Колагенова спіраль складається з трьох спіральних ланцюгів, які закручуються («зчеплюються») один навколо одного й утворюють суперспіраль.
Третинна структура характеризує спосіб і особливості упаковки α-спіралі або β-складчастої структури в найкомпактніший спосіб (наприклад у глобулу).
Четвертинна структура — це характерний спосіб поєднання і розміщення у просторі окремих поліпептидних ланцюгів, що складають одну функціонально індивідуальну молекулу (поєднання кількох глобул). [1], c.429- 479; [2], c. 423-441, 643-647.
Контрольні запитання та завдання
1. Чому в молекулах нітросполук атоми Гідрогену біля α-карбонових атомів, по відношенню до нітрогрупи, рухливіші, ніж у молекулах оксосполук? Поясніть це з точки зору електронної будови.
2. Напишіть структурні формули ароматичних амінів, які є більш основними, ніж анілін. Розмістіть їх у ряд за зростанням основності.
3. Поясніть, чому основні властивості трифеніламіну значно слабші за основні властивості аніліну.
4. Побічними реакціями при діазотуванні можуть бути: а) розщеплення нітритної кислоти; б) розщеплення солей діазонію; в) утворення діазоаміносполук. Які умови реакції потрібні для запобігання цим процесам? Як визначають закінчення реакції діазотування?
5. Запропонуйте для кожної з наведених пар сполук хімічні реакції, за допомогою яких можна розрізнити ці сполуки. Наведіть рівняння відповідних реакцій:
а) фенілнітрометан та м-нітротолуен; б) анілін та циклогексиламін;
в) п- толуїдин та N -метиланілін; г) N -нітрозо- N -метиланілін та п -нітрозо -N -метиланілін.
6. Поясніть, чому аміди типу 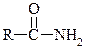 є сильнішими кислотами (слабкішими основами), ніж аміни.
є сильнішими кислотами (слабкішими основами), ніж аміни.
8. Які з амінокислот, наведених у табл., належать до основних, а які до кислих? У якій з наведених сполук Нітроген є найменш основним, а який — найбільш основним? Які з карбоксильних груп є найменш, а які — найбільш кислими? Доведіть свої міркування.
Література
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2884; Нарушение авторских прав?; Мы поможем в написании вашей работы!