
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа
|
|
|
|
Энергия.

т. е. для дискретного набора отрицательных значений энергии.

Самый нижний уровень Е 1, отвечающий минимальной возможной энергии, — основной, все остальные (Еn >Е 1, n = 2, 3,...) — возбужденные При Е <0 движение электрона является связанным Из рисунка следует, что по мере роста главного квантового числа n энергетические уровни располагаются теснее и при n =¥ E ¥ = 0.
При Е >0 движение электрона является свободным; область непрерывного спектра Е >0 (
соответствует ионизованному атому. Энергия ионизации атома водорода равна
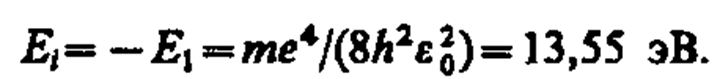
уравнению Шредингера удовлетворяют собственные функции 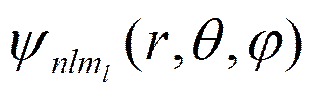 , определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным тl.
, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным тl.
Главное квантовое число n определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы:
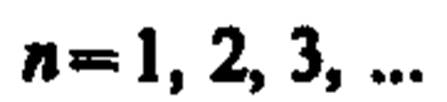
момент импульса (механический орбитальный момент) электрона квантуется —принимает дискретные значения, определяемые формулой

где l — орбитальное квантовое число, которое при заданном n принимает значения

т. е. всего n значений, и определяет момент импульса электрона в атоме.
вектор L l момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llx на направление z внешнего магнитного поля принимает квантованные значения, кратные ћ:
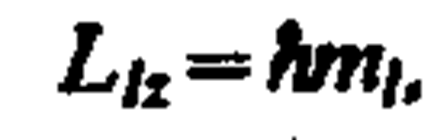
где тl — магнитное квантовое число, которое при заданном l может принимать значения

т. е. всего 2 l +1 значений.
Таким образом, магнитное квантовое число ml определяет проекцию момента импульса электрона на заданное направление,
Наличие квантового числа ml должно привести в магнитном поле к расщеплению уровня с главным квантовым числом п на 2 l +1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. Действительно, расщепление энергетических уровней в магнитном поле было обнаружено в 1896 г. голландским физиком П. Зееманом (1865—1945) и получило название эффекта Зеемана. Расщепление уровней энергии во внешнем электрическом поле, тоже доказанное экспериментально, называется эффектом Штарка.
Квантовые числа п и l характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве.
В атомной физике, по аналогии со спектроскопией, состояние электрона, характеризующееся квантовыми числами l= 0, называют s -состоянием (электрон в этом состоянии называют s -электроном), l =1 — p -состоянием, l= 2 — d -состоянием, l =3 — f -состоянием и т. д
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 378; Нарушение авторских прав?; Мы поможем в написании вашей работы!