
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрованные растворы (стандартные растворы), используемые для титриметрических определений.Особенности приготовления и установки титра (стандартизации)
|
|
|
|
Методы идентификации (установления подлинности), используемые в фармакопейном анализе. Первая и вторая идентификация.
Приводимые в этом разделе испытания не рассчитаны на полное
подтверждение химической структуры или состава продукта. Они предназначены
для подтверждения с приемлемой степенью достоверности того, что продукт
соответствует информации, приведенной на этикетке.
В некоторых частных фармакопейных статьях имеются подразделы «Первая
идентификация» и «Вторая идентификация». Обычно используют первую
идентификацию. Если имеется гарантия того, что данная серия субстанции была
ранее сертифицирована на соответствие всем требованиям частной
фармакопейной статьи, испытания из второго подраздела могут использоваться
вместо испытаний из первого подраздела.
Раствор, концентрация активного вещества в котором известна с высокой точностью, называется стандартным раствором.

Растворы титрантов можно готовить также из фиксаналов и методом ионного обмена. Фиксаналом (нормадозой, стандарт-титром) называются приготовленные и расфасованные в промышленных условиях порции вещества, содержащие точно известное его количество. Содержимое фиксанала растворяют в указанном объёме растворителя (обычно объём раствора составляет 1 л) и получают раствор с точной концентрацией растворённого вещества.
Стандартным веществом в титриметрии называется реагент, используемый для стандартизации раствора титранта.
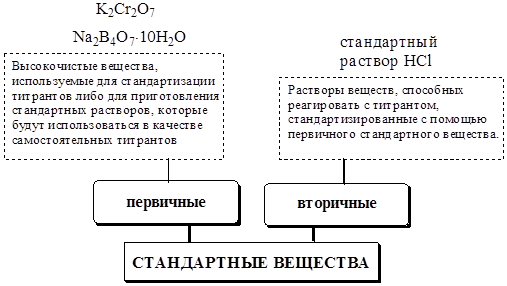
В качестве первичных стандартных веществ используют соединения, обладающие следующими свойствами:
· состав строго соответствует химической формуле;
· выпускаются промышленностью в чистом виде (квалификация не ниже «ч.д.а.») либо легко подвергаются очистке;
· устойчивы при обычных условиях;
· нелетучи и, по возможности, не содержат кристаллизационной воды (можно использовать и кристаллогидраты, если они устойчивы).
· имеют большую молярную массу (меньше погрешность при измерении массы).
Если стандартный раствор титранта используется для серийных анализов, то для его количественной характеристики удобно использовать титр соответствия (титр по определяемому веществу), который показывает массу определяемого вещества, взаимодействующего с 1 мл данного титранта. Например, титр 0,1000 М HCl по NaOH равен 4,000×10-3 г/мл.
Титр соответствия рассчитывается заранее для определённой концентрации вещества в стандартном растворе. Представим себе, что в лаборатории закончился 0,1000 М HCl и новый приготовленный раствор HCl оказался немного более концентрированным (или более разбавленным), чем исходный, например 0,1005 М. В таких случаях удобнее не пересчитывать величину титра соответствия, а ввести поправочный коэффициент (k), например, в данном случае он равен 1,005.

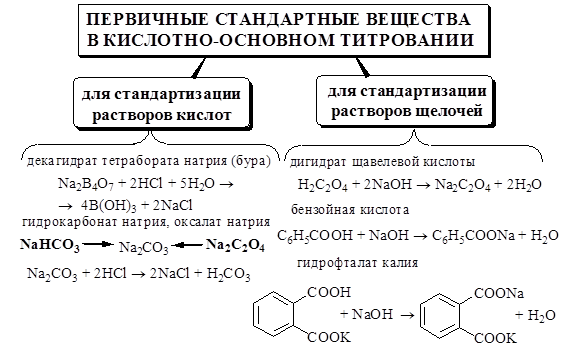
В качестве титранта в меркуриметрическом титровании используют Hg(NO3)2. Стандартный раствор этого вещества является вторичным. Исходным веществом для его приготовления служит Hg(NO3)2×H2O. Данное вещество плохо растворимо в воде, поэтому его растворяют в небольшом количестве азотной кислоты. После того как соль растворится, раствор разбавляют водой до нужного объёма. Для стандартизации используют NaCl или стандартный раствор NH4SCN.
Этилендиаминтетрауксусная кислота малорастворима в воде, поэтому в качестве титранта используют её динатриевую соль – Na2H2Y×2H2O, называемую трилоном Б, динатрия эдетатом и т.д. Для динатриевой соли соли этилендиаминтетрауксусной кислоты допускается такая же аббревиатура, как и для самой кислоты – ЭДТА. Растворимость Na2H2Y×2H2O в воде при 20 °С составляет примерно 0,3 моль/л. В титриметрии чаще всего используют 0,05 М растворы этого вещества.
Поскольку любые определяемые катионы металла и ЭДТА всегда взаимодействуют друг с другом в молярном соотношении 1:1 использование понятия «эквивалент» в комплексонометрии не имеет смысла.
Стандартные растворы ЭДТА могут быть как первичными, так и вторичными. Для получения первичного стандартного вещества очищенный образец Na2H2Y×2H2O высушивают в течение нескольких дней при температуре 80 °С и относительной влажности 50%. Чаще стандартные растворы ЭДТА готовят вначале с приблизительной концентрацией, а затем проводят стандартизацию с помощью различных металлов (Zn, Bi, Fe и др.), которые растворяют в кислоте, а также CaCO3, железоаммонийных квасцов и т.д.
Основным титрантом, используемым в аргентометрии, является нитрат серебра. Стандартный раствор AgNO3, как правило, готовится как вторичный стандартный раствор. В качестве первичного стандартного вещества для его стандартизации применяют NaCl. Для удаления гигроскопической влаги химически чистый хлорид натрия прокаливают при температуре 400-500 °С до постоянной массы. Конечную точку при титровании NaCl стандартизируемым раствором AgNO3 обнаруживают с помощью K2CrO4. Ионы Ag+ на свету быстро восстанавливаются до металлического серебра, поэтому раствор AgNO3 следует хранить в сосудах тёмного стекла с притёртыми пробками в защищённом от света месте.
В методе Фольгарда в качестве титранта используют NH4SCN или KSCN. Стандартные растворы этих веществ являются вторичными. Для стандартизации применяют стандартный раствор AgNO3.
В качестве титрантов в иодометрическом титровании используют иод (трииодид) и тиосульфат натрия.
Растворимость иода в воде при 20 °С составляет примерно 1,3×10-3 моль/л. В присутствии KI за счёт протекания реакции образования [I3]- растворимость иода заметно увеличивается
Содержание молекулярного иода в полученном растворе оказывается значительно меньшим по сравнению с [I3]-, поэтому такой раствор следовало бы называть раствором трииодида. Однако, поскольку I2 и [I3]- ведут себя в окислительно-восстановительных реакциях практически одинаково, раствор, полученный при растворении I2 в присутствии KI, традиционно называют раствором иода.
Стандартный раствор иода может быть первичным или вторичным. Образец иода, используемый для получения первичного стандартного раствора, подвергают дополнительной очистке. Очищаемый образец иода вначале растирают с KI (для удаления хлора и брома) и CaO (для удаления воды), а затем подвергают возгонке.
Если раствор иода готовится как вторичный стандартный раствор, то его необходимо подвергнуть стандартизации. В фармацевтической практике раствор иода обычно стандартизируют с помощью стандартного раствора Na2S2O3.
Основными процессами, ведущими к изменению концентрации [I3]- в стандартном растворе, являются улетучивание иода и окисление I- до I2 кислородом воздуха. Последний процесс ускоряется на свету и в присутствии катионов некоторых металлов. Из всего этого следует, что стандартный раствор иода следует хранить в прохладном и защищённом от света месте в сосудах тёмного стекла с притёртыми пробками. Корковые или резиновые пробки для укупорки сосудов использовать нельзя.
Для приготовления стандартного раствора тиосульфата натрия используют Na2S2O3×5H2O. Это вещество является неустойчивым. Оно легко подвергается выветриванию, взаимодействует в растворе с CO2, может окисляться кислородом воздуха и разлагаться тиобактериями
Na2S2O3 + CO2 + H2O ® NaHSO3 + S¯ + NaHCO3
2Na2S2O3 + O2 ® 2S¯ + 2Na2SO4
Стандартный раствор тиосульфата натрия является вторичным. Для его приготовления навеску Na2S2O3×5H2O растворяют в свежепрокипячённой воде. Для увеличения рН в раствор добавляют немного безводного Na2CO3. После приготовления раствор Na2S2O3 выдерживают несколько суток в закрытом сосуде в защищённом от света месте, а затем подвергают стандартизации. Стандартный раствор Na2S2O3 хранят в сосудах тёмного стекла с притёртыми пробками в защищённом от света месте. Для предотвращения взаимодействия данного вещества с CO2 сосуды защищают хлоркальциевыми трубками. Для того чтобы в растворе не развивались тиобактерии, к нему можно добавить небольшое количество антисептика: фенола, бензоата натрия, хлороформа и др.
Для стандартизации растворов Na2S2O3 используют K2Cr2O7 либо стандартный раствор иода. Реакции Na2S2O3 с K2Cr2O7 и другими сильными окислителями протекают нестехиометрично, поэтому стандартизацию тиосульфата натрия проводят способом титрования заместителя:


Первую из данных реакций проводят в кислой среде (H2SO4) и в присутствии 3-4-кратного избытка KI. Иодид-ионов должно хватить не только на реакцию с дихроматом калия, но и на растворение образующегося иода. Реакция взаимодействия K2Cr2O7 и KI требует некоторого времени, поэтому после смешивания реагентов колбу закрывают стеклом и оставляют в защищённом от света месте на 5-10 минут. После этого раствор разбавляют водой (для уменьшения кислотности) и титруют выделившийся иод стандартизируемым раствором Na2S2O3.
Реакцию взаимодействия иода с тиосульфатом натрия проводят при рН 0 – 7. В щелочной среде иод превращается в иодид и гипоиодит, который окисляет тиосульфат не до тетратионата, как I2, а до сульфата.
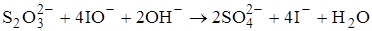
Хлориодометрическое титрование, в целом, похоже на иодометрическое. Хлорид иода является более сильным окислителем, чем иод и более сильным электрофилом, что позволяет использовать его в качестве реагента в реакциях иодирования органических соединений. Растворы ICl более устойчивы, чем растворы [I3]-.
Монохлорид иода представляет собой ионное соединение и находится в растворе HCl в виде комплекса I+[ICl2]-.
Стандартный раствор ICl является вторичным. Это вещество получают окислением иодида калия иодатом калия в присутствии HCl:
2 KI + KIО3 + 6 НCl ® 3 ICl + 3KCl + 3Н2О
Для того чтобы убедиться, что в растворе не осталось избытка иодида или иодата, поступают следующим образом

После проведения данных операций смеси дают некоторое время отстояться и затем водную фазу переносят в мерную колбу и доводят водой до метки. Растворы ICl при условии того, что они содержат достаточное количество HCl, довольно устойчивы. Их хранят в сосудах тёмного стекла в защищённом от света месте.
Стандартизацию раствора ICl обычно проводят способом иодометрического титрования. К стандартизируемому раствору прибавляют избыток KI и оставляют в защищённом от света месте на 15 минут.
ICl + KI ® I2 + KCl
Выделившийся иод титруют стандартным раствором Na2S2O3.
Иодат калия обладает всеми свойствами первичного стандартного вещества, поэтому стандартные растворы этого вещества можно готовить по точной навеске KIO3. При необходимости стандартизацию растворов проводят иодометрически. Вначале проводят реакцию
KIO3 + 5KI + 3H2SO4 ® 3I2 + 3K2SO4 + 3H2O
Затем выделившийся иод титруют стандартным раствором Na2S2O3.
Стандартный раствор KBrO3 можно готовить по точной навеске этого вещества. Стандартизацию раствора проводят иодометрически:
2KBrO3 + 10KI + 12HCl ® 5I2 + 3KCl + 6H2O,
Выделившийся иод титруют стандартным раствором Na2S2O3.
Стандартный раствор NaNO2 является вторичным. В качестве первичного стандартного вещества для его стандартизации обычно используют сульфаниловую кислоту.

Перманганатометрическое титрование чаще всего проводят в кислой среде, реже - в нейтральной или щелочной. Для создания кислой среды применяют серную кислоту. Азотная кислота, в особенности содержащая оксиды азота, сама является сильным окислителем, а хлороводородная, наоборот, может окисляться титрантом.
 E0 = +1,51В
E0 = +1,51В
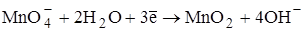 E0 = +0,60В
E0 = +0,60В
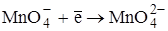 E0 = + 0,54В
E0 = + 0,54В
Стандартный раствор KMnO4 является вторичным. Приготовление и стандартизация данного раствора имеет ряд особенностей. Свежеприготовленный раствор кипятят в течение 10 минут, а затем выдерживают несколько дней для того, чтобы прошли процессы окисления органических веществ, которые могут содержаться в воде. Образовавшийся осадок MnO2 следует обязательно удалить, так как данное вещество катализирует восстановление перманганата. Диоксид марганца отфильтровывают с помощью стеклянного (но не бумажного!) фильтра.
Стандартные растворы KMnO4 следует хранить в сосудах тёмного стекла с притёртыми пробками. Концентрация КMnO4 в растворе с течением времени постепенно уменьшается. Особенно неустойчивы разбавленные растворы KMnO4. При длительном хранении раствора КMnO4 на стенках сосуда может образовываться коричневый налёт MnO2. Сосуды, стенки которых покрыты таким налётом, использовать для дальнейшего хранения раствора KMnO4 нельзя.
Стандартизацию растворов KMnO4 проводят каждый раз перед применением. В качестве первичного стандартного вещества используют Na2C2O4, а также H2C2O4×2H2O, Fe, As2O3 и другие вещества. Оксалат натрия негигроскопичен, легко подвергается очистке, разрушается лишь при температуре больше 240 °С. Реакция взаимодействия между перманганат- и оксалат-ионами
 ,
,
несмотря на большое значение ЭДС, протекает медленно, поэтому её проводят при нагревании (около 70°С). Данная реакция является автокаталитической - роль катализатора выполняют ионы Mn2+, образующиеся в ходе реакции. Кипятить раствор нельзя, так как оксалаты и щавелевая кислота при этом разрушаются.
Н2С2О4 ® Н2О + СО2 + СО
Стандартный раствор K2Cr2O7 является первичным. Он устойчив при хранении. В отличие от KMnO4 дихромат не восстанавливается следами органических веществ и хлорид-ионов, содержащихся в воде. Для обнаружения конечной точки титрования обычно используют окислительно-восстановительные индикаторы: дифениламин, ферроин и др.
Стандартный раствор Ce(SO4)2 готовят из Ce(SO4)2×4H2O или Ce(SO4)2×2(NH4)2SO4×2H2O путём растворения навески в 1 М серной кислоте. Стандартный раствор Ce(SO4)2 обычно является вторичным. Для его стандартизации используют Na2C2O4, соль Мора, заместительное иодометрическое титрование и т.д.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 6512; Нарушение авторских прав?; Мы поможем в написании вашей работы!