
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Феноловый красный
|
|
|
|
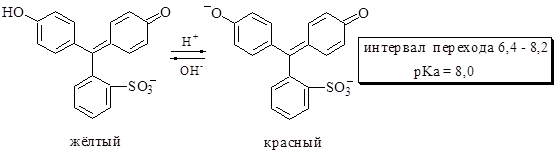
Требования, предъявляемые к кислотно-основным индикаторам
· Вещества, используемые в качестве индикаторов, должны обладать интенсивной окраской (иметь большой молярный коэффициент светопоглощения).
· Изменение окраски должно быть контрастным (большая разность между lмакс поглощения кислотной и основной форм).
· Интервал перехода окраски должен быть узким, а процесс изменения окраски обратимым.
Для повышения контрастности изменения окраски используют смешанные и контрастные индикаторы.
Смешанный индикатор состоит из двух индикаторов, имеющих примерно одинаковый интервал перехода окраски, причём окраска одного из индикаторов является дополнительной для другого. Один индикатор поглощает электромагнитное излучение видимого диапазона с такими длинами волн, которые не поглощает другой индикатор. В результате смесь поглощает часть проходящего через неё светового излучения во всём видимом диапазоне и поэтому кажется серой.
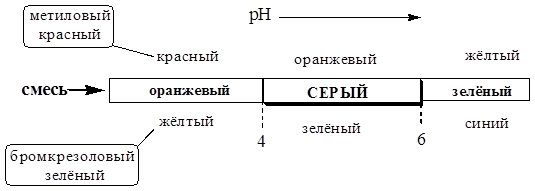
Контрастный индикатор «работает» по такому же принципу, что и смешанный, однако, вместо второго индикатора используется вещество, окраска которого не зависит от рН.
Смеси из трёх и более индикаторов называются универсальными индикаторами. Универсальные индикаторы обычно используют для количественного определения рН.
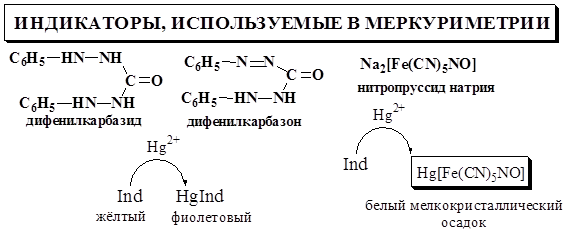
Дифенилкарбазон представляет собой слабую кислоту, поэтому его взаимодействие с ионами Hg2+ зависит от рН.
В случае титрования хлоридов pHопт = 1,5 – 2 (верхний предел может быть расширен до 4). В более кислой среде чувствительность индикатора уменьшается, и определяемое вещество будет перетитровано. При увеличении рН индикатор, наоборот, начинает образовывать с Hg2+ окрашенное соединение до точки эквивалентности, вследствие чего определяемое вещество оказывается недотитрованным.
Для создания оптимального значения рН к титруемому раствору прибавляют азотную кислоту, как правило, до концентрации 0,02 – 0,04 моль/л. При обнаружении конечной точки титрования с помощью дифенилкарбазида титрование проводят в слабокислой или нейтральной среде.
Нитропруссид натрия можно использовать для обнаружения конечной точки титрования сильнокислых растворов.
металлоиндикаторов – веществ, изменяющих окраску (или флуоресценцию) в зависимости от концентрации катионов металла в растворе.

Некоторые металлоиндикаторы, относящиеся ко второй группе, образуют с катионами металлов флуоресцирующие внутрикомплексные соединения. Такие индикаторы называются металлофлуоресцентными.
Эриохром чёрный Т (хромоген чёрный ЕТ 00) - металлохромный индикатор из группы азокрасителей. Представляет собой трёхосновную кислоту, однако, на окраску влияет ионизация только OH-групп, но не SO3H-группы. Образует окрашенные внутрикомплексные соединения с катионами более 20 металлов.
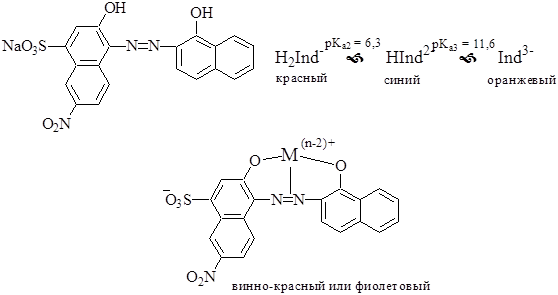
Эриохром чёрный Т используют для обнаружения конечной точки комплексонометрического титрования катионов различных металлов в щелочных растворах (как правило, при рН 8-10).
В растворах (особенно щелочных) эриохром чёрный Т быстро окисляется кислородом воздуха, поэтому его применяют в виде твёрдого вещества. Поскольку индикатор интенсивно окрашен, его разбавляют NaCl (1:200) и затем приготовленную смесь вносят в титруемый раствор.
Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
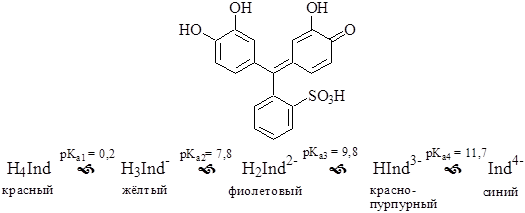
Может быть использован для обнаружения конечной точки комплексонометрического титрования при различном значении рН, например, Bi3+ при рН 2-3, Cu2+ - рН 5-6 (ацетатный буферный раствор), Mg2+, Ni2+, Zn2+ - рН 9-10 (аммиачный буферный раствор).
Ксиленоловый оранжевый -индикатор из группы сульфофталеиновых красителей. Представляет собой шестиосновную кислоту.
Формы H6Ind – H3Ind3- окрашены в жёлтый цвет, остальные – в красный. Комплексы с катионами металлов имеют красную или пурпурную окраску. Так же как и пирокатехиновый фиолетовый, ксиленоловый оранжевый может быть использован для обнаружения конечной точки комплексонометрического титрования при различных значениях рН, например, Bi3+ - при рН 1-3, Pb2+ - при рН 5-6 (ацетатный буферный раствор), Ca2+ и Mg2+ - при рН 10.
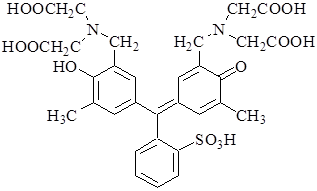

Мурексид – это аммониевая соль 5,5’-нитрилодибарбитуровой кислоты
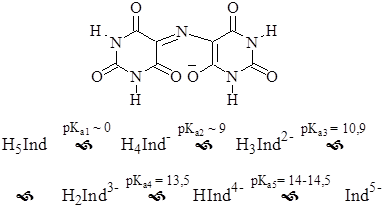
Неионизированная кислота окрашена в жёлтый цвет, моноанион – фиолетовый, дианион – голубой.
Мурексид может образовывать протонированные комплексы разного состава, имеющие различную окраску. Например, комплекс CaH4Ind+ (lgb = 2,6) окрашен в жёлто-оранжевый цвет, CaH3Ind - (lgb = 3,6) – в красно-оранжевый, CaH2Ind- + (lgb = 5,0) – в красный.
Мурексид может играть роль металлохромного индикатора при различных значениях рН. Например, комплексонометрическое определение ионов Cu2+ с данным индикатором проводят при рН 4 (ацетатный буферный раствор), Ni2+ - при рН 9-11 (аммиачный буферный раствор), Ca2+ - при рН > 12. В водных растворах мурексид быстро разрушается, поэтому его применяют в виде смеси с NaCl (1:100).
Сущность обнаружения конечной точки комплексонометрического титрования с помощью металлохромного индикатора заключается в следующем. При добавлении индикатора к исходному раствору титруемого катиона металла образуется окрашенный растворимый комплекс. В процессе титрования данного раствора ЭДТА в точке эквивалентности или вблизи неё комплекс катиона металла с индикатором разрушается, и окраска раствора становится такой же, как и у раствора индикатора при данном значении рН.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 3309; Нарушение авторских прав?; Мы поможем в написании вашей работы!