
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процессы изменения состояния идеальных газов
|
|
|
|
З-5.5
З-5.4
З-5.3
З-5.2
З-5.1
Задачи
Решение.
П-5.2
Найти изменение внутренней энергии 1 кг воздуха при переходе его от начального состояния t1 = 300 ºС до конечного при t2 = 50 ºС. Зависимость теплоемкости от температуры принять линейной. Ответ дать в кДж.
Изменение внутренней энергии найдем по формуле:
 u=cvm(t2-t1).
u=cvm(t2-t1).
Пользуясь приложением К, получим для воздуха
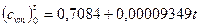 кДж/(кг·К);
кДж/(кг·К);
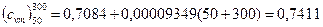 кДж/(кг·К).
кДж/(кг·К).
Следовательно,
 u = 0,7411(50-300)= -185,3 кДж/кг.
u = 0,7411(50-300)= -185,3 кДж/кг.
Производится испытание двигателя, во время которого двигатель вместо того, чтобы принимать полезную нагрузку, тормозится.
На сколько градусов нагреется охлаждающая тормоз вода, если крутящий момент двигателя равен 5 кДж, а частота вращения –
1500 об/мин. Известно, что к колодкам тормоза подводится 10 т/ч воды при температуре 15 ºС. Предполагается, что вся работа двигателя превращается в теплоту трения.
Ответ: на 67,6 К.
Свинцовый шар падает с высоты 80 м на твердую поверхность. При этом кинетическая энергия шара переходит в теплоту, 80 % которой им усваивается.
На сколько градусов нагревается при падении шар?
Теплоемкость свинца ср = 0,1256 кДж/(кг·К)
Ответ: на 5 К.
В сосуд, содержащий 5 л воды при температуре 20 ºС, помещен электронагреватель мощностью 800 Вт.
Определить, сколько времени потребуется, чтобы вода нагревалась до температуры кипения 100 ºС. Потерями теплоты сосуда в окружающую среду пренебречь.
Ответ: 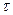 = 30 мин.
= 30 мин.
Автомобиль массой 1,5 т останавливается под действием тормозов при скорости 40 км/ч.
Вычислить конечную температуру тормозов t2, если их масса равна 15 кг,начальная температура t1 =10 С, а теплоемкость стали, из которой изготовлены тормозные части, равна 0,46 кДж/(кг·К). Потерями теплоты в окружающую среду пренебречь.
Ответ: t2= 23,4 ºС.
Найти изменение внутренней энергии 2 м3 воздуха, если температура его понижается от t1 = 250 ºС до t2 = 70 ºС. Зависимость теплоемкости от температуры принять линейной. Начальное давление воздуха p1 = 0,6 МПа.
Ответ:  U = -1063кДж.
U = -1063кДж.
Основными термодинамическими процессами являются:
1) Изохорный процесс – процесс сообщения или отнятия теплоты при постоянном объеме газа (v=const). Зависимость между начальными и конечными параметрами процесса
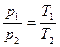 . (6.1)
. (6.1)
Изменение внутренней энергии
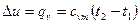 . (6.2)
. (6.2)
Если в процессе участвует М кг или Vн м3 газа, то количество теплоты или изменение внутренней энергии газа
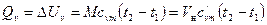 . (6.3)
. (6.3)
Совершаемая в процессе работа
l=0, L=0. (6.4)
Изменение энтропии
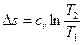 . (6.5)
. (6.5)
2) Изобарный процесс - процесс сообщения или отнятия теплоты при постоянном давлении газа (р=const). Зависимость между начальными и конечными параметрами процесса
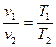 . (6.6)
. (6.6)
Изменение внутренней энергии
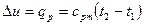 . (6.7)
. (6.7)
Работа 1 кг газа
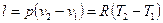 . (6.8)
. (6.8)
Для М кг газа
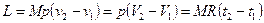 . (6.9)
. (6.9)
Если в процессе участвует М кг или Vн м3 газа, то количество теплоты
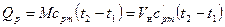 . (6.10)
. (6.10)
Изменение энтропии
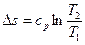 . (6.11)
. (6.11)
3) Изотермический процесс - процесс сообщения или отнятия теплоты при постоянной температуре газа (t=const). Зависимость между начальными и конечными параметрами процесса
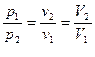 . (6.12)
. (6.12)
Изменение внутренней энергии
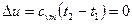 . (6.13)
. (6.13)
Работа 1 кг газа
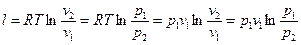 . (6.14)
. (6.14)
Если в процессе участвует М кг газа, то полученные значения следует увеличить в М раз, также можно удельный объем v заменить на полный объем V
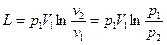 . (6.15)
. (6.15)
Количество теплоты, сообщаемое газу или отнимаемое от него
qt=l. (6.16)
Теплота для М кг газа
Qt=L. (6.17)
Изменение энтропии
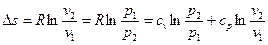 . (6.18)
. (6.18)
4) Адиабатный процесс – процесс без сообщения или отнятия теплоты (dq=0, s = const). Уравнение адиабаты pvk=const при (cv=const), где k – показатель адиабаты (см. формулу (4.2) и таблицу 3).
Зависимость между начальными и конечными параметрами процесса
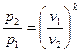 ,
, 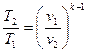 ,
, 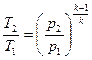 . (6.19)
. (6.19)
Изменение внутренней энергии
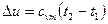 . (6.20)
. (6.20)
Уравнение первого закона термодинамики для адиабатного процесса имеет вид
0=du+dl, (6.21)
следовательно
du= - dl,или Δu= - l. (6.22)
Изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку.
Работа 1 кг газа
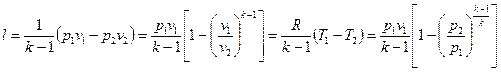 . (6.23)
. (6.23)
Для М кг газа
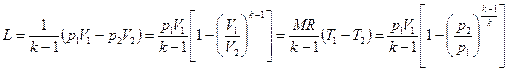 . (6.24)
. (6.24)
Количество теплоты, сообщаемое газу или отнимаемое от него
q=0. (6.25)
Изменение энтропии
Δ s = 0. (6.26)
5) Политропный процесс – процесс, при котором изменение параметров подчиняется уравнению pvn=const, где n – показатель политропы, величина постоянная для данного процесса. Характеристикой политропного процесса является величина φ – коэффициент разветвления теплоты, т.е. доля теплоты, затрачиваемая на изменение внутренней энергии рабочего тела.
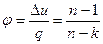 . (6.27)
. (6.27)
Показатель политропы определяется из уравнения
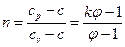 . (6.28)
. (6.28)
Если известны значения двух параметров в начальном и конечном состоянии
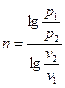 ,
, 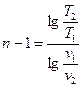 ,
, 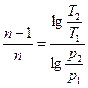 . (6.29)
. (6.29)
Для процессов расширения:
а) n<1 – теплота подводится (q>0), внутренняя энергия газа увеличивается (Δu>0);
б) k>n>1 – теплота подводится (q>0), внутренняя энергия газа уменьшается (Δu<0);
в) n> k – теплота отводится (q<0), внутренняя энергия газа уменьшается (Δu<0).
Для процессов сжатия
а) n<1 – теплота отводится (q<0), внутренняя энергия газа уменьшается (Δu<0);
б) k>n>1 – теплота отводится (q<0), внутренняя энергия газа увеличивается (Δu>0);
в) n> k – теплота подводится (q>0), внутренняя энергия газа увеличивается (Δu>0).
Зависимость между начальными и конечными параметрами процесса
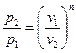 ,
, 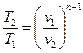 ,
, 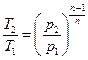 . (6.30)
. (6.30)
Изменение внутренней энергии
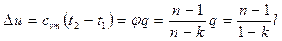 . (6.31)
. (6.31)
Работа 1 кг газа
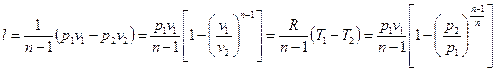 . (6.32)
. (6.32)
Если количество теплоты, участвующее в процессе известно
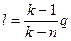 . (6.33)
. (6.33)
Для М кг газа
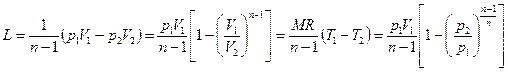 . (6.34)
. (6.34)
Если количество теплоты, участвующее в процессе известно
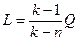 . (6.35)
. (6.35)
Теплоемкость политропного процесса
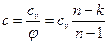 . (6.36)
. (6.36)
Количество теплоты, сообщаемой газу или отнимаемой от него
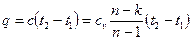 ; (6.37)
; (6.37)
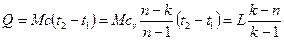 . (6.38)
. (6.38)
Изменение энтропии
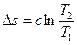 . (6.39)
. (6.39)
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 4906; Нарушение авторских прав?; Мы поможем в написании вашей работы!