
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическая часть. Методические указания по решению задач
|
|
|
|
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Методические указания по решению задач
индивидуального задания
для студентов I курса всех специальностей
и форм обучения
Новосибирск 2009
Методические указания разработаны:
к.х.н., доцентом С. В. Сысоевым,
к.х.н., доцентом В. А. Шестаковым,
к.х.н., Т. М. Крутской
Утверждены методической комиссией СТФ
____________2009г.
Рецензенты:
-Н.А. Старцева, к.х.н., доцент кафедры химии (НГАСУ).
-Т.П. Чусова, к.х.н., старший научный сотрудник ИНХ СО РАН
ИСПОЛЬЗУЕМЫЕ ОБОЗНАЧЕНИЯ
DН0f – стандартная энтальпия образования вещества при Т = 298 K, кДж/моль
DН0r – изменение энтальпии в реакции при стандартных условиях, кДж
DН0пл – молярная энтальпия плавления вещества, кДж/моль
DН0исп – молярная энтальпия испарения вещества, кДж/моль
S0(B) – стандартная энтропия вещества при Т = 298 K, Дж/моль× К
DS0r – изменение энтропии в реакции при стандартных условиях (Т = 298 К), Дж/ К
DG0f – стандартная энергии Гиббса образования вещества при Т = 298 K, кДж/моль
DG0r – изменение энергии Гиббса реакции при стандартных условиях, кДж
Т – температура, К
P – давление, Па
m(B) – масса вещества с формульной единицей В
M(B) – молярная масса вещества, г/моль
n(B) = m(B)/ M(B) – количество вещества, моль
VО(B) – объем газообразного вещества при нормальных условиях
VmО(B) – молярный объем газообразного вещества при нормальных условиях, л/моль
Z(В) – эквивалентное число
nэк(B) = n(B) . Z(В) – количество вещества эквивалентов, моль-эк
Mэк(B) = M(B)/ Z(В) – молярная масса вещества эквивалентов, г/моль-эк
VэкО(B) = VmО(B)/Z(В) – молярный объем эквивалентов газообразного вещества, л/моль-эк (н.у.)
(н.у.) – нормальные условия, T=273K, P=101,3кПа
(с.у.) – стандартные условия, T=298K, P=101,3кПа
С.О.(Э) – степень окисления элемента
I. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
В процессах химических превращений веществ из исходных реагентов (начальное состояние химической системы) в продукты реакции (конечное состояние) происходит изменение числа и свойств химических связей, а значит, и изменение энергии системы. Поэтому любая химическая реакция характеризуется некоторым энергетическим эффектом. Обычно энергетический эффект представляют как выделение или поглощение теплоты (Q) и называют тепловым эффектом реакции, хотя в реакции могут изменяться и другие формы энергии (электрическая, электромагнитного излучения).
В изобарных условиях (p=const) тепловой эффект химической реакции QP равен изменению энтальпии реакции:
QP = DU + pDV = DH.
Энтальпия и другие термодинамические функции (внутренняя энергия, энтропия, свободная энергия Гиббса) являются экстенсивными величинами, т. е. величинами зависящими от количества вещества. Поэтому тепловой эффект химической реакции должен быть соотнесен с определенным числом молей вещества n (В), участвующим в процессе.
При этом количество вещества связано с массой данной порции вещества или с объемом газообразного вещества при нормальных условиях соотношениями:
n(B) = m(B)/ M(B) (1),
n(B) = VО(B)/ 22,4. (2).
Таким образом, тепловой эффект реакции при p = const и стандартных условиях (p= 1 атм = 101323 Па, Т = 298 К, газ идеальный), отнесенный к тем количествам веществ, которые указаны в уравнении реакции, называется стандартной энтальпией химической реакции 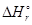 (В) и измеряется в Дж или кДж. При этом количество определенного вещества равно соответствующему стехиометрическому коэффициенту в уравнении реакции (n (B)). Если теплота в ходе реакции выделяется
(В) и измеряется в Дж или кДж. При этом количество определенного вещества равно соответствующему стехиометрическому коэффициенту в уравнении реакции (n (B)). Если теплота в ходе реакции выделяется 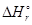 < 0, то реакция называется экзотермической. Если теплота в ходе реакции поглощается, то
< 0, то реакция называется экзотермической. Если теплота в ходе реакции поглощается, то 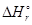 > 0 и реакция называется эндотермической. Уравнение реакции, записанное с указанием теплового эффекта и агрегатного состояния реагирующих веществ, называется термохимическим уравнением.
> 0 и реакция называется эндотермической. Уравнение реакции, записанное с указанием теплового эффекта и агрегатного состояния реагирующих веществ, называется термохимическим уравнением.
Например:
N2 (г) + 3H2 (г) = 2NH3 (г); 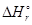 = -92,4 кДж.
= -92,4 кДж.
Данная запись означает, что при взаимодействии 1 моль азота (n(N2)) и 3 моль водорода (n(H2)) образуется 2 моль аммиака (n(NH3)) и при этом выделяется соответствующее количество теплоты.
Одной из основных количественных характеристик вещества является его с тандартная энтальпия образования DH°f(В). Эти величины молярные, отнесены на 1 моль вещества (кДж/моль) и являются справочными величинами. Стандартной энтальпией образования сложного вещества называется тепловой эффект изобарного процесса (изменение энтальпии) образования 1 моль вещества при стандартных условиях из соответствующего количества молей простых веществ, находящихся в стандартном состоянии и при стандартных условиях. Стандартным состоянием вещества называется такое его химическое и агрегатное состояние, которое наиболее устойчиво при стандартных условиях. Стандартные энтальпии образования простых веществ 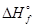 (В) принимаются равными нулю.
(В) принимаются равными нулю.
Например, стандартная энтальпия образования кристаллического Na2CO3 (тв) равна тепловому эффекту следующей реакции:
2Na(тв)+C(тв, графит) +1,5O2(Г)=Na2CO3(тв), 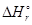 =
= 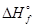 (Na2CO3 (тв)).
(Na2CO3 (тв)).
Данная запись означает, что при взаимодействии 2 моль твердого натрия (термодинамически устойчивое состояние при стандартных условиях) с 1 моль твердого углерода (графита, а не алмаза) и 1,5 моль газообразного молекулярного кислорода O2 (стандартное состояние), образуется 1 моль сложного вещества Na2CO3(тв). Важно, что в правой части уравнения 1 моль сложного вещества, а в левой части соответствующее количество простых веществ в стандартном состоянии (коэффициенты могут быть и дробными).
Зная величины стандартных энтальпий образования участвующих в химической реакции веществ 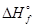 (В) можно рассчитать энтальпию химической реакции
(В) можно рассчитать энтальпию химической реакции 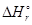 . В основе расчетов лежит одно из следствий закона Гесса, которое для произвольной реакции:
. В основе расчетов лежит одно из следствий закона Гесса, которое для произвольной реакции:
nA A + nB B = nC C + nD D (3),
может быть записано следующим образом:
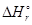 = Snj
= Snj 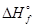 (продукты) - Sni
(продукты) - Sni 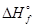 (исходные) =
(исходные) =
= (nC 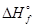 (C) + nD
(C) + nD 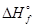 (D)) -(nA
(D)) -(nA 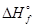 (A) + nB
(A) + nB 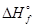 (B)) (4).
(B)) (4).
Первый член этого уравнения является суммой произведений стандартных энтальпий образования продуктов реакции на соответствующие стехиометрические коэффициенты. Второй член – аналогичная сумма для исходных веществ. При расчете 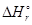 не следует забывать о знаках энтальпий образования и помнить, что полученные величины
не следует забывать о знаках энтальпий образования и помнить, что полученные величины 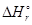 относятся к тому числу молей, которые указаны в уравнениях реакций (3).
относятся к тому числу молей, которые указаны в уравнениях реакций (3).
Проводя ту или иную реакцию, совсем не обязательно берут строго стехиометрические количества реагентов, соответствующие коэффициентам в уравнении реакции -n(B). Количество вещества может быть любым другим - n(В). Тогда другим будет и тепловой эффект, обозначим его 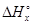 . Но соотношение между количествами реагирующих и образующихся веществ останется прежним. Составим пропорцию:
. Но соотношение между количествами реагирующих и образующихся веществ останется прежним. Составим пропорцию:
на n(В) моль вещества ® изменение энтальпии 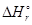 ,
,
на n(В) моль этого вещества ® изменение энтальпии 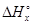 .
.
Решая пропорцию относительно 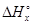 , получаем:
, получаем:
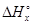 =
= 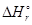 ×n(B)/n(B) (5).
×n(B)/n(B) (5).
В данном разделе два основных типа задач:
Расчет теплового эффекта процесса Q = 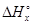 с использованием соотношения (5) при заданном количестве вещества n(В), массы m(В) или объема VО(B);
с использованием соотношения (5) при заданном количестве вещества n(В), массы m(В) или объема VО(B);
Расчет количества вещества (массы, объема) с использованием соотношения (5) при известном количестве выделяемой или поглощаемой теплоты 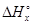 .
.
И в том и в другом случае энтальпия реакции рассчитывается по уравнению (4) с использованием справочных данных для 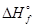 (В).
(В).
В приведенных задачах предполагается, что зависимостью величин энтальпии реакции от температуры можно пренебречь, а условия проведения процесса близки к стандартным.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!