
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Задача 1. Кристаллогидраты сульфатов магния и кальция образуются по реакциям:
|
|
|
|
Задача 1. Кристаллогидраты сульфатов магния и кальция образуются по реакциям:
MgSO4 (Tв) + 6H2O(Г) = MgSO4 . 6H2O (Tв)
 кДж/моль -1173,3 -228,6 -2635,1
кДж/моль -1173,3 -228,6 -2635,1
CaSO4 (Tв) + 2H2O(Г) = CaSO4 . 2H2O (Tв)
 кДж/моль -1322,0 -228,6 -1797,0
кДж/моль -1322,0 -228,6 -1797,0
Определить, какой из этих кристаллогидратов более устойчив к обезвоживанию при 25°С.
Решение. Реакции обезвоживания кристаллогидратов, являются обратными по отношению к приведенным выше. Таким образом, для решения задачи следует проверить устойчивость кристаллогидратов по отношению к следующим реакциям:
MgSO4 . 6H2O(Tв) = MgSO4(Tв) + 6H2O(Г)
CaSO4 . 2H2O(Tв) = CaSO4(Tв) + 2H2O(Г)
Определим величины 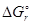 для этих реакций. В соответствии с выражением (9):
для этих реакций. В соответствии с выражением (9):
для первой реакции 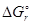 = 6
= 6  (H2O(Г)) +
(H2O(Г)) +  (MgSO4(Tв)) -
(MgSO4(Tв)) -  (MgSO4 . 6H2O(Tв)) = 6×(-228,6)-1173,3+2635,1 = 90.2 кДж;
(MgSO4 . 6H2O(Tв)) = 6×(-228,6)-1173,3+2635,1 = 90.2 кДж;
для второй реакции 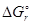 = 2
= 2  (H2O(Г)) +
(H2O(Г)) +  (CaSO4(Tв)) -
(CaSO4(Tв)) -  (CaSO4 . 2H2O(Tв)) =2×(-228,6) -1322,0 + 1797,0 = 17.8 кДж.
(CaSO4 . 2H2O(Tв)) =2×(-228,6) -1322,0 + 1797,0 = 17.8 кДж.
Поскольку 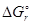 для первой реакции больше, чем для второй, кристаллогидрат магния более устойчив к обезвоживанию.
для первой реакции больше, чем для второй, кристаллогидрат магния более устойчив к обезвоживанию.
Ответ. MgSO4 . 6H2O (Tв) более устойчив.
Задача 2. Определить направление самопроизвольного процесса при 25°С
Сs2О (Tв) + 4SiO2 (Tв) = Сs2О×4SiO2 (Tв)
 кДж/моль -274,5 -856,7 -4058,4
кДж/моль -274,5 -856,7 -4058,4
Найти величину изменения энергии Гиббса системы, если известно, что в этом процессе израсходовалось (или образовалось) 3 кг оксида кремния.
Решение. Для определения направления самопроизвольного процесса рассчитаем энергию Гиббса заданной реакции. 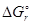 =
=  (Сs2О×4SiO2(Tв)) -
(Сs2О×4SiO2(Tв)) -  (Сs2О(Tв)) - 4
(Сs2О(Tв)) - 4  (SiO2(Tв)) = -4058,4 + 274,5 + 4×856,7 = -357,1 кДж. Так как
(SiO2(Tв)) = -4058,4 + 274,5 + 4×856,7 = -357,1 кДж. Так как 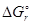 < 0, самопроизвольной является прямая реакция.
< 0, самопроизвольной является прямая реакция.
Для ответа на второй вопрос задачи необходимо составить пропорцию. M(SiO2) = 60 г/моль. Согласно уравнению, при участии в реакции четырех молей, т.е. 4×60 = 240 граммов оксида кремния изменение энергии Гиббса системы составит -357,1 кДж. Требуется найти изменение энергии Гиббса отвечающее реакции 3000 г оксида кремния. Поэтому пропорция имеет вид:
по уравнению: 240 г ® -357,1 кДж
по условию: 3000 г ® x кДж
Отсюда x = 3000 г × (-357,1 кДж)/ 240 г =.-4463,87 кДж.
Ответ. Самопроизвольной является прямая реакция, 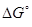 = -4463,87 кДж.
= -4463,87 кДж.
Задача 3. Определите, какой из двух процессов может осуществляться в прямом направлении при 25°С? Как повлияет на вероятность протекания этого процесса увеличение температуры?
Na2O(Тв) + SO2(Г) = Na2SO3(Тв)
 кДж/моль -379,3 -300,2 -1001,2
кДж/моль -379,3 -300,2 -1001,2
CaCO3(Tв) = CaО(Г) + CO2(Г)
 кДж/моль -1128,4 -603,5 -394,4
кДж/моль -1128,4 -603,5 -394,4
Решение. Определим величины энергии Гиббса этих реакций. Для первой реакции:
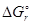 =
=  (NaSO3(Тв)) -
(NaSO3(Тв)) -  (Na2O(Тв)) -
(Na2O(Тв)) -  (SO2 (Тв)) = -1001,2 + 379,3 + 300,2 = -321,7 кДж.
(SO2 (Тв)) = -1001,2 + 379,3 + 300,2 = -321,7 кДж.
Для второй реакции:
 =
=  (CO2 (Г)) -
(CO2 (Г)) -  (СаО (Tв)) -
(СаО (Tв)) -  (CaCO3(Tв)) = -394,4 - 603,5 + 1128,4 = 130,5 кДж.
(CaCO3(Tв)) = -394,4 - 603,5 + 1128,4 = 130,5 кДж.
Таким образом, для первой реакции 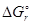 < 0, для второй
< 0, для второй 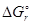 > 0. Это означает, что в прямом направлении может осуществляться только первый процесс. Для ответа на второй вопрос задачи необходимо определить знак изменения энтропии в этом процессе. Так как в результате этой реакции уменьшается количество вещества в газовой фазе, то
> 0. Это означает, что в прямом направлении может осуществляться только первый процесс. Для ответа на второй вопрос задачи необходимо определить знак изменения энтропии в этом процессе. Так как в результате этой реакции уменьшается количество вещества в газовой фазе, то 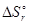 < 0. В соответствии с уравнением (8) при повышении температуры это приведет к увеличению
< 0. В соответствии с уравнением (8) при повышении температуры это приведет к увеличению 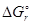 и, следовательно, к снижению вероятности реакции.
и, следовательно, к снижению вероятности реакции.
Ответ. В прямом направлении может осуществляться первый процесс. При повышении температуры его вероятность уменьшается.
Задача 4. При взаимодействии 10 г оксида кальция с H2SO4(Г) по реакции:
CaO(Тв) + H2SO4(Г) = CaSO4(Тв) + H2O(Г)
 кДж/моль -603,5? -1322,0 -228,6
кДж/моль -603,5? -1322,0 -228,6
энергия Гиббса системы уменьшилась на 52,7 кДж. Определить  (H2SO4(Г)).
(H2SO4(Г)).
Решение. Запишем выражение для энергии Гиббса реакции. 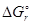 =
=  (H2O(Г)) +
(H2O(Г)) +  (CaSO4(Тв)) -
(CaSO4(Тв)) -  (СаО(Tв)) -
(СаО(Tв)) -  (H2SO4(Г)).
(H2SO4(Г)).
В этом уравнении два неизвестных 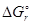 и
и  (H2SO4(Г)). Согласно условию задачи при участии в реакции 10 г CaO величина DG составляет –52,7 кДж. Из уравнения реакции следует, что величина
(H2SO4(Г)). Согласно условию задачи при участии в реакции 10 г CaO величина DG составляет –52,7 кДж. Из уравнения реакции следует, что величина 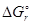 отвечает участию в реакции одного моля оксида кальция (М(CaO) = 56.1 г/моль). Поэтому пропорция для определения величины DGr имеет вид:
отвечает участию в реакции одного моля оксида кальция (М(CaO) = 56.1 г/моль). Поэтому пропорция для определения величины DGr имеет вид:
по условию: 10 г ® –52,7 кДж
по уравнению: 56,1 г ® 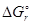
Отсюда 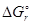 = –52,7×56,1/10 = -295,6 кДж. Выразив из уравнения величину
= –52,7×56,1/10 = -295,6 кДж. Выразив из уравнения величину  (H2SO4(Г)) можно получить:
(H2SO4(Г)) можно получить:  (H2SO4(Г))=
(H2SO4(Г))=  (H2O(Г) ) +
(H2O(Г) ) +  (CaSO4(Т)) -
(CaSO4(Т)) -  (СаО(T)) -
(СаО(T)) - 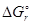 = -228,6 -1322,0 + 603,5 + 295,6 = -651,5 кДж.
= -228,6 -1322,0 + 603,5 + 295,6 = -651,5 кДж.
Ответ.  (H2SO4(Г)) = -651,5 кДж.
(H2SO4(Г)) = -651,5 кДж.
Задача 5. Уменьшение энергии Гиббса при установлении равновесия в системе при стандартных условиях, состоящей из O2(Г), NO(Г), NO2(Г), составило 44,5 кДж. Определить, соответствующее изменение объема системы при нормальных условиях (н.у.).
Решение. Между газами, указанными в условии задачи, возможна следующая реакция:
0,5O2(Г) + NO(Г) = NO2(Г)
 кДж/моль 0 87,6 52,3
кДж/моль 0 87,6 52,3
Для определения направления этой реакции в стандартных условиях рассчитаем величину стандартной энергии Гиббса:
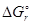 =
=  (NO2(Г) ) -
(NO2(Г) ) -  (NO(Г)) - 0,5
(NO(Г)) - 0,5  (O2(Г)) = 52,3 - 87,6 – 0,5×0 = -35,3 кДж.
(O2(Г)) = 52,3 - 87,6 – 0,5×0 = -35,3 кДж.
Поскольку 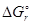 < 0, реакция пойдет в прямом направлении. При этом величине
< 0, реакция пойдет в прямом направлении. При этом величине 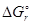 = -35,3 кДж соответствует уменьшение количество вещества газа на 0,5 моля. (0,5 моля O2(Г) и 1 моль NO(Г) превратились в 1 моль NO2(Г)).
= -35,3 кДж соответствует уменьшение количество вещества газа на 0,5 моля. (0,5 моля O2(Г) и 1 моль NO(Г) превратились в 1 моль NO2(Г)).
Уменьшение числа молей в системе, соответствующее 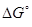 = -35,4 кДж найдем по пропорции:
= -35,4 кДж найдем по пропорции:
по реакции: -35,3 кДж ® 0,5 моля
по условию: -44,5 кДж ® x молей
Решив пропорцию получим: x = 0,5×44,5/35,3 = 0,630 моль.
Поскольку при н. у. объем газа занимает 22,4 литра, уменьшение объема системы составит 22,4×0,63 = 14,1 литра.
Ответ. Объем системы уменьшится на 14,1 литра.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 660; Нарушение авторских прав?; Мы поможем в написании вашей работы!