
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Задача 1. Рассчитайте изменение энтропии в процессе протекания реакции:
|
|
|
|
Задача 1. Рассчитайте изменение энтропии в процессе протекания реакции:
2Al(Tв) + 1,5O2(Г) = Al2O3(Tв),
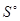 Дж/моль×К 28,3 205,0 50,9
Дж/моль×К 28,3 205,0 50,9
если известно, что при нормальных условиях израсходовалось 5 литров кислорода.
Решение. Найдем стандартную энтропию указанной реакции. 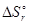 =
= 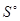 (Al2O3(Tв)) - 2
(Al2O3(Tв)) - 2 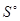 (Al(Tв)) - 1,5
(Al(Tв)) - 1,5 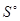 (O2(Г)) =
(O2(Г)) =
50,9 - 2×28,3 - 1,5×205,0 = -313,2 Дж/К.
Это изменение энтропии соответствует расходу по реакции 22,4×1,5 = 33,6 литров кислорода (1 моль газа при н.у. занимает объем 22,4 литра). Теперь можно составить пропорцию:
по уравнению: 33,6 л ® -313,2 Дж/К 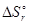 = -313,2 Дж/К
= -313,2 Дж/К
по условию: 5 л ® 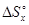 Дж/К
Дж/К
Решив пропорцию относительно 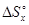 получаем:
получаем:
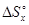 = 5×(-313,2)/33,6 = -46,6 Дж/К
= 5×(-313,2)/33,6 = -46,6 Дж/К
Ответ. Изменение энтропии составит -46,6 Дж/К.
Задача 2. Определить 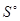 (H2O(Г)), если известно что при испарении 9 граммов воды при с.у. поглощается 17,7 кДж тепла, а S0(H2O(Ж)) = 70,0 Дж/моль.К.
(H2O(Г)), если известно что при испарении 9 граммов воды при с.у. поглощается 17,7 кДж тепла, а S0(H2O(Ж)) = 70,0 Дж/моль.К.
Решение. Найдем молярную теплоту испарения, учитывая, что 9 г воды составляет 9/M(H2O) = 9/18 = 0.5 моля. Составим пропорцию:
0.5 моля ® 17,7 кДж
моль ® x кДж
Отсюда: x = 1×17,7/0.5 = 35,4 кДж/моль = 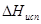 . Стандартным условиям отвечает температура 298 К. Согласно соотношению (7)
. Стандартным условиям отвечает температура 298 К. Согласно соотношению (7) 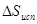 =
= 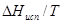 = 35,4/298 = 0,119 кДж/моль.К = 119 Дж/моль.К.
= 35,4/298 = 0,119 кДж/моль.К = 119 Дж/моль.К.
Далее, 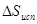 =
= 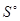 (H2O(Г)) -
(H2O(Г)) - 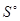 (H2O(Ж)).
(H2O(Ж)).
Поэтому 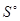 (H2O(Г))=
(H2O(Г))= 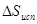 +
+ 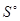 (H2O(Ж))=119+70,0=189Дж/моль.К.
(H2O(Ж))=119+70,0=189Дж/моль.К.
Ответ. 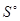 (H2O(Г)) = 189 Дж/моль.К.
(H2O(Г)) = 189 Дж/моль.К.
Задача 3. Определить направление самопроизвольного процесса в изолированной системе для следующей реакции:
Fe2O3 (Тв) + 3H2 (Г) = 2Fe(Tв) + 3H2O (Г)
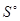 Дж/моль×К 89,9 130,6 27,1 188,7
Дж/моль×К 89,9 130,6 27,1 188,7
Решение. Направление самопроизвольного процесса в изолированной системе определяется знаком изменения энтропии. Найдем стандартную энтропию заданной реакции.
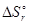 = 3
= 3 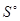 (H2O(Г)) + 2
(H2O(Г)) + 2 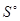 (Fe(T)) -
(Fe(T)) - 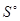 (Fe2O3(T)) - 3
(Fe2O3(T)) - 3 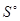 (H2(Г)) = 3×188,7 + 2×27,1 - 89,9 - 3×130,6 = 138,6 Дж/К.
(H2(Г)) = 3×188,7 + 2×27,1 - 89,9 - 3×130,6 = 138,6 Дж/К.
Ответ. Поскольку для заданной реакции DS0r > 0, в изолированной системе самопроизвольно может протекать прямая реакция.
Задача 4. Смешали 1 моль РbО2(T) с 2 молями цинка при 25°С. Рассчитайте энтропию получившейся системы, предполагая:
а) полное отсутствие химического взаимодействия между этими веществами;
б) полное превращение этих веществ по реакции:
РbО2 (Tв) + 2Zn (Tв) = Рb (Tв) + 2ZnО (Tв)
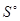 Дж/моль×К 76,4 42,0 65,0 43,5
Дж/моль×К 76,4 42,0 65,0 43,5
Решение. В случае а) энтропия системы будет равна суммарной энтропии веществ, составляющих систему, (реагентов) c учетом их количества. Таким образом, для заданной системы в отсутствие взаимодействия:
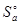 =
= 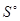 (РbО2(Tв)) + 2×
(РbО2(Tв)) + 2× 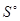 (Zn(Tв)) = 76,4 + 2×42,0 = 160,4 Дж/К. В случае б) энтропия системы будет равна суммарной энтропии продуктов реакции:
(Zn(Tв)) = 76,4 + 2×42,0 = 160,4 Дж/К. В случае б) энтропия системы будет равна суммарной энтропии продуктов реакции:
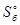 =
= 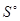 (Рb(Tв)) + 2×
(Рb(Tв)) + 2× 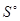 (ZnO(Tв)) = 65,0 + 2×43,5,0 = 152,0 Дж/К
(ZnO(Tв)) = 65,0 + 2×43,5,0 = 152,0 Дж/К
Ответ. а) 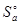 = 160,4 Дж/К, б)
= 160,4 Дж/К, б) 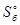 = 152,0 Дж/К.
= 152,0 Дж/К.
V. НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ ПРОЦЕССОВ
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1024; Нарушение авторских прав?; Мы поможем в написании вашей работы!