
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия
|
|
|
|
Термическое уравнение состояния: V = f (T, P, ni), (3.1)
например, V= (RT/P)Σ ni – для идеального газа.
Калорическое уравнение состояния: U= f (T, V, ni)(3.1а)
Термодинамика основана на установленных опытным путем законах, так называемых началах, откуда могут быть выведены все зависимости между термодинамическими величинами.
Первое начало термодинамики(частный случай закона сохранения энергии):
В закрытой системе изменение внутренней энергии Δ U равно разности теплоты Q, поглощенной системой из окружающей среды, и работы A, произведенной системой над окружением:
Δ U = Q − A (3.2)
Первое начало термодинамики исключает возможность создания вечного двигателя первого рода, который при помощи кругового процесса (Δ U = 0)совершал бы работу большую подводимой извне энергии в форме тепла (А = Q).
Работа А в большинстве случаев совершается в форме работы расширения А = P Δ V. Дифференциальная форма 1-го начала для этого случая имеет вид:
δ Q = dU + P dV. (3.2')
Второе начало термодинамики взаимосвязано с определением энтропии. Её изменение Δ S выражается через поглощенную системой теплоту для обратимо протекающего процесса в закрытой системе:
Δ S =  . (3.3)
. (3.3)
В соответствующем необратимом процессе с присущими ему внутренними теплопотерями, в частности, на трение количество поглощенной и «усвоенной» системой теплоты будет меньше, а изменение энтропии от начального до конечного состояния будет больше соответствующего необратимому процессу интеграла:
Δ S >  . (3.3')
. (3.3')
Поскольку все процессы в природе в той или иной степени необратимы, то в изолированной системе ( 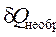 = 0 ), в которой протекают самопроизвольные, т.е. необратимые процессы, всегда наблюдается увеличение энтропии (Δ S > 0) .
= 0 ), в которой протекают самопроизвольные, т.е. необратимые процессы, всегда наблюдается увеличение энтропии (Δ S > 0) .
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!