
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процессы, приводящие к уменьшению энтропии, в изолированных или замкнутых системах невозможны
|
|
|
|
Если к термодинамической системе, состоящей из огромного числа частиц, подходить с позиции вероятностных законов, то представляется очевидным, что любой самопроизвольный процесс протекает в направлении, при котором система переходит из менее вероятного в более вероятное состояние.
Этот вывод может служить одной из формулировок второго начала термодинамики.
Покажем, что статистическая формула Больцмана S = R ×ln W, которая выражает энтропию через вероятность термодинамического состояния W,действительно соответствует определению энтропии через приведенную (т.е. деленную на температуру) теплоту d Q / T. Доказательство выполним для модели идеального газа, начав с вычисления теплоты, приобретенной системой при обратимом изотермическом (Δ U = 0, см. далее) расширении 1 моля идеального газа.
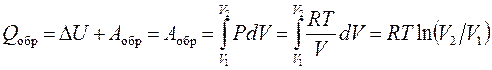 . (3.4)
. (3.4)
Очевидно, что чем больше объем V, тем больше вероятность нахождения в нем рассматриваемого моля газа. Заменяя отношение V 2/ V 1 равным ему W 2/ W 1 и сопоставляя деленное на Т соотношение (3.4) с вытекающим из формулы Больцмана изменением энтропии
D S = S 2 – S 1 = R ×ln(W 2/ W 1), получаем D S = Q обр/ T, которое соответствует определению (3.3).
Далее, не сложно показать, что найденная работа обратимого изотермического расширения (3.4) всегда больше работы соответствующего необратимого процесса
А необр = P (V 2 – V 1) = RT (V 2 – V 1)/ V 2 = RT (1 – V 1/ V 2), (3.5)
когда отпущенный при объёме V 1 поршень первоначально сжатого в цилиндре газа в условиях постоянного внешнего давления P (возможно после нескольких колебаний) остановится в положении с объёмом V 2. Неравенство вычисленных работ А обр > А необр для рассмотренного идеального газа в изотермическом (Δ U = 0) процессе с учетом первого закона термодинамики приводит к неравенству Q обр > Q необр. Его деление на T дает неравенство Δ S > Q необр / T, (3.6)
которое обосновывает принципиальную часть второго начала термодинамики (3.3').
Второе начало термодинамики исключает возможность создания вечного двигателя второго рода, т.е. устройства, в котором при помощи кругового процесса охлаждается источник тепла, причем все количество теплоты превращается в механическую работу. Возможно лишь частичное превращение теплоты в работу (в противоположность обратному процессу).
Коэффициент полезного действия процесса, в котором происходит превращение теплоты в работу: 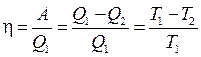 . (3.7)
. (3.7)
Q 1и Q 2 – количества теплоты отданное нагревателем и поглощенное холодильником, находящимся, соответственно, при температуре Т 1и Т 2. Второе равенство в (3.7) справедливо для полностью обратимых процессов (например, для цикла Карно).
Все естественные процессы (например, в тепловых машинах) протекают с меньшим коэффициентом полезного действия.
Дифференциальная форма соотношения (3.6) после подстановки в него (3.2) объединяет 1-ое и 2-ое начала термодинамики: TdS > dU + PdV + δ A необр. При этом в совершаемой системой общей работе по всем ее видам выделена работа расширения PdV. В окончательной форме основного термодинамического соотношения
TdS ≥ dU + PdV + δ A (3.8)
знак равенства относится к обратимым процессам, а знак неравенства - к необратимым.
В изолированной системе (dU = 0, dV = 0,δ A= 0), т. е. при фиксированных U и V, как следует из (3.8), могут протекать процессы только с возрастанием энтропии: (dS) U,V ≥ 0 (3.9)
В результате такого самопроизвольного процесса при рассматриваемых условиях (U, V = const) система приходит в состояние равновесия, а её энтропия достигает максимального значения. Соответствующие критерии равновесия в математической форме имеют вид:
(dS) U,V = 0, (d 2 S) U,V < 0. (3.10)
3. 2. Характеристические функции
Совершаемая системой работа А, при её выражении из основного термодинамического соотношения (3.8)
δ A ≤ TdS - dU - PdV (3.11)
будет максимальной при обратимом процессе (знак равенства в (3.11)). Например, максимальную полезную работу в химической реакции можно получить, если проводить её в обратимом гальваническом элементе.
Величина полезной работы будет зависеть от условий протекания реакции.
3.2.1. В самопроизвольном процессе при условии постоянства S, V (dS =0, dV =0),согласно (3.11), δ A ≤ - (dU) S , V. Максимальная полезная работа равна убыли внутренней энергии системы U:
(A обр) S , V = - (Δ U) S , V = - (U 2 – U 1) S , V (3.12)
Внутренняя энергия как характеристическая функция объема V и непосредственно не измеряемой энтропии S не удобна и редко используется в термодинамике для решения практических задач.
3.2.2. Для самопроизвольного процесса при постоянных S, Р из (3.11) следует
δ A ≤ (- dU - PdV) S , Р = − (dU + PdV) S , Р = − (dН) S , Р. (3.13)
Максимальная полезная работа при данных условиях равна убыли энтальпии системы Н = U + PV.
3.2.3. Для самопроизвольного процесса при постоянных Р и Т соотношение (3.11) можно представить в виде
δ A ≤ − d (U + PV − TS) T , Р , (3.14)
поскольку дифференциал в последнем выражении при постоянных Р и Т действительно соответствует (3.11). Функция
G = U + PV – TS = H – TS (3.15)
называется термодинамическим потенциалом Гиббса или энергией Гиббса. Для обратимого процесса при постоянных Р и Т максимальная полезная работа равна убыли этой важнейшей для химии термодинамической функции состояния.
3.3. Критерии возможности и направленности самопроизвольного процесса и условия равновесия
Если направленность самопроизвольного процесса в изолированной системе определяется возрастанием энтропии (3.9), а равновесие – условиями её максимума (3.10), то для закрытых систем ответы на эти вопросы получают на основании величины полезной работы А > 0.
Максимальная полезная работа при задаваемых условиях постоянства параметров процесса (нижние индексы) определяется убылью соответствующей функции состояния или соответствующего термодинамического потенциала:
δ A = - (dU) S , V , δ A = - (dH) S , P , δ A = - (dF) T , V , δ A = - (dG) T , P . (3.16)
Т. о. при самопроизвольном протекании физико-химического или химического процесса в закрытой системе соответствующие условиям процесса термодинамические потенциалы должны уменьшаться, достигая в равновесии минимальных величин, удовлетворяющих критериям равновесия:
(dU) S , V = 0, (dH) S , P = 0, (dF) T , V = 0, (dG) T , P = 0; (3.17)
(d 2 U) S , V > 0, (d 2 H) S , P >0, (d 2 F) T , V >0, (d 2 G) T , P >0. (3.18)
К ранее введенным добавлен изохорно-изотермический потенциал (энергия Гельмгольца) F = U – TS. Поскольку большинство процессов в закрытых системах совершаются при постоянных Т и Р, то наиболее важны и используемы на практике соотношения для энергии Гиббса.
3.4. Основные термодинамические функции индивидуальных веществ
Количество тепла, принимаемое молем вещества, при повышении его температуры на 1 градус, называется его мольной теплоемкостью, соответственно при постоянном объеме или при постоянном давлении
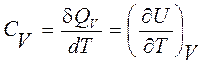 ,
,  . (3.19)
. (3.19)
Непосредственное использование 1-го начала термодинамики в форме (3.2') показывает, что CV связана с изменением внутренней энергии. Дифференциал энтальпии Н = U + P · V при постоянном давлении (dH)Р = dU + P · dV = (δ Q) Р сопоставленный с (3.2') показывает, что CР взаимосвязана с изменением энтальпии.
Вытекающая из последнего соотношения взаимосвязь мольных теплоемкостей при постоянном давлении и постоянном объеме для газов (верхняя строка в (3.20)) легко устанавливается с использованием мольного уравнения Менделеева-Клапейрона.
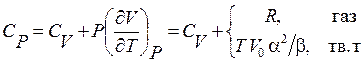 (3.20)
(3.20)
Для твердых тел (нижняя строка) эта взаимосвязь выражается через молярный объем при 0 К (V 0), изобарический коэффициент термического расширения (α) и изотермический коэффициент сжимаемости твердого тела (β).
Энтальпия нагревания вещества при изменении температуры от Т 1 до Т 2 − результат интегрирования CР (3.19):
 . (3.21)
. (3.21)
Температурное изменение энтропии при постоянном давлении следует из исходных определений энтропии (3.3) и теплоемкости CР:
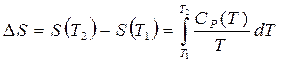 . (3.21')
. (3.21')
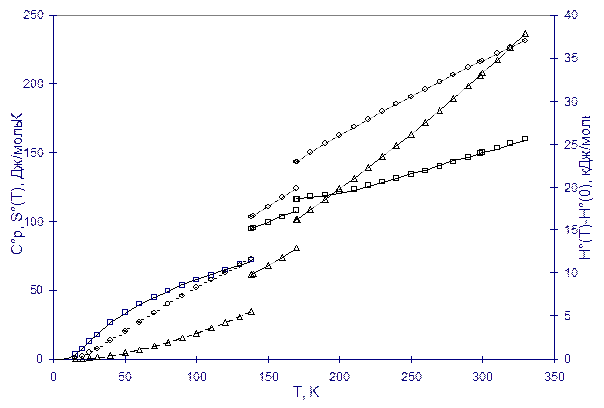
На рисунке приведен результат калориметрических измерений теплоемкости (квадратики) циклогексена - исходной функции для расчета энтальпии (кружочки) и энтропии (треугольники).
Термохимия (термодинамический раздел химии), кроме теплоемкости, занимается определением температур Tk и теплот 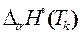 фазовых и полиморфных превращений.
фазовых и полиморфных превращений.
При наличии такой информации основные (наиболее используемые) термодинамические функции рассчитываются по формулам
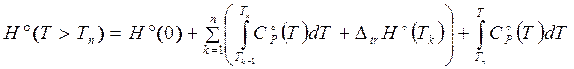 , (3.23)
, (3.23)
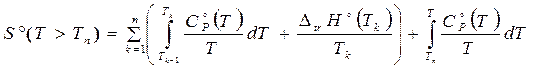 . (3.24)
. (3.24)
Дополненные стандартными энтальпиями образования (см. далее) они составляют основу термодинамических банков данных.
3.5. Термодинамические функции реакций
Предваряя анализ тепловых эффектов химических реакций, ещё раз остановимся насимвольном уравнении химической реакции
| ν'1 A1 + ν'2 A2 = ν3 A3 + ν4 A4. (3H2 + N2 = 2NH3) (3.25') |
| Δ n 1 = − ν'1·ξ, Δ n 2 = − ν'2·ξ, Δ n 3 = +ν3·ξ, Δ n 4 = +ν4 ξ. (3.26') |
Реагенты в уравнении реакции, естественно, со сменой знака перенесём в правую часть
0 = ν1 A1 + ν2 A2 + ν3 A3 + ν4 A4. (0 = −3H2 −N2 + 2NH3).
Стехиометрические коэффициенты для реагентов при этом следует считать отрицательными: (ν1 = -ν'1, ν2 = - ν'2). Компактное и математически изящное уравнение химической реакции из произвольного числа компонентов принимает вид:
0 = Σν i A i, ν i < 0 для реагентов. (3.25)
Все текущие, в том числе и конечные количества реагентов и продуктов реакции единообразно выражаются через реакционную переменную ξ,:
Δ ni = ν i ξ, ni = n 0 i + ν i ξ. (3.26)
Изменение числа молей при протекании реакции пропорционально стехиометрическому коэффициенту – закон кратных отношений.
Если реакция происходит при постоянном объеме V, то указанный закон будет действовать и для концентраций (Ci = ni /(V, л)) − молярности). Разделив (3.26) на V получим
Δ Сi = ν i ξ', Сi = С 0 i + ν i ξ', где ξ' = ξ/ V (3.26')
Закон сохранения массы для реакции (3.25) с использованием соотношений (3.26) 0 = ΣΔ mi = Σ(Mi Δ ni) = ξ Σ(Mi ν i) сводится к равной нулю стехиометрической сумме мольных масс Mi: Σ Mi ν i = 0.
Реакции синтеза аммиака 3H2 + N2 = 2NH3 соответствует менее привычная для химиков (1) (2) (3)
форма (3.25): 0 = −3H2 − N2 + 2NH3. Убывающим по реакции веществам соответствуют отрицательные стехиометрические коэффициенты, а прибывающим – положительные. В частности, исходному «стехиометрическому» составу n 01 =3 моль, n 02 =1 моль, n 03 =0 моль при «полном, 100%-ном» завершении реакции соответствует ξ = 1 моль(последняя строка нижеследующей таблички).
Таблица. Три задачки
| 1 | 2 | 3 | 1 | 2 | 3 | |
| (3.26): n 0 i = ni - νi ξ | ξ=(ni - n 0 i)/ νi | (3.26): ni = n 0 i + νi ξ | ||||
| (0-1)/(-1)=1 | 5-3*1=2 | 10+2*1=12 | ||||
| 4+3*2=10 | 4+2=6 | (4-0)/2=2 | ||||
| (2-0)/2=1 | 3-3*1=0 | 1-1=0 |
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!